Чадний газ взаємодіє з. Що таке "чадний газ"
Вуглець утворює два надзвичайно стійкі оксиди (ЗІ і С 2), три значно менш стійкі оксиди (С 3 O 2 , С 5 O 2 і С 12 O 9), ряд нестійких або погано вивчених оксидів (С 2 O, С 2 O 3 та ін) та нестехіометричний оксид графіту. Серед перерахованих оксидів особливу роль відіграють СО та СО 2 .
ВИЗНАЧЕННЯ
Монооксид вуглецюза звичайних умов горючий газ без кольору та запаху.
Він досить токсичний через його здатність утворювати комплекс із гемоглобіном, який приблизно в 300 разів стійкіший, ніж комплекс кисень-гемоглобін.
ВИЗНАЧЕННЯ
Діоксид вуглецюпри звичайних умовах - безбарвний газ, приблизно в 1,5 рази важчий за повітря, завдяки чому його можна переливати, як рідина, з однієї судини в іншу.
Маса 1 л CO 2 за нормальних умов становить 1,98 р. Розчинність діоксиду вуглецю у воді невелика: 1 об'єм води при 20 o З розчиняє 0,88 об'єму CO 2 , а при 0 o С - 1,7 об'єму.
Пряме окислення вуглецю при нестачі кисню або повітря призводить до утворення СО, при достатній їх кількості утворюється СО 2 . Деякі властивості цих оксидів представлені у табл. 1.
Таблиця 1. Фізичні властивості оксидів вуглецю.
Одержання оксиду вуглецю
Чистий СО може бути отриманий в лабораторії дегідратуванням мурашиної кислоти (НСООН) концентрованої сірчаної кислоти при ~140 °С:
HCOOH = CO + H2O.
У невеликих кількостях діоксид вуглецю можна легко одержати дією кислот на карбонати:
CaCO 3 + 2HCl = CaCl 2 + H 2 O + CO 2 .
У промисловому масштабі CO 2 отримують головним чином як побічний продукт у процесі синтезу аміаку:
CH 4 + 2H 2 O = CO 2 + 4H 2;
CO + H2O = CO2 + H2.
Великі кількості вуглекислого газу одержують при випаленні вапняку:
CaCO3 = CaO+CO2.
Хімічні властивості оксиду вуглецю
Монооксид вуглецю хімічно активний за високих температур. Він поводиться як сильний відновник. Реагує з киснем, хлором, сіркою, аміаком, лугами, металами.
CO + NaOH = Na (HCOO) (t = 120 - 130 o C, p);
CO + H 2 = CH 4 + H 2 O (t = 150 - 200 o C, kat. Ni);
CO + 2H 2 = CH 3 OH (t = 250 - 300 o C, kat. CuO/Cr 2 O 3);
2CO + O 2 = 2CO 2 (kat. MnO 2 / CuO);
CO + Cl 2 = CCl 2 O(t = 125 - 150 o C, kat. C);
4CO + Ni = (t = 50 - 100 o C);
5CO + Fe = (t = 100 - 200 o C, p).
Діоксид вуглецю виявляє кислотні властивості: реагує із лугами, гідратом аміаку. Відновлюється активними металами, воднем, вуглецем.
CO 2 + NaOH dilute = NaHCO 3;
CO 2 + 2NaOH conc = Na 2 CO 3 + H 2 O;
CO 2 + Ba(OH) 2 = BaCO 3 + H 2 O;
CO 2 + BaCO 3 + H 2 O = Ba (HCO 3) 2;
CO 2 + NH 3 × H 2 O = NH 4 HCO 3;
CO 2 + 4H 2 = CH 4 + 2H 2 O (t = 200 o C, kat. Cu 2 O);
CO 2 + C = 2CO (t> 1000 o C);
CO 2 + 2Mg = C + 2MgO;
2CO 2 + 5Ca = CaC 2 + 4CaO (t = 500 o C);
2CO 2 + 2Na 2 O 2 = 2Na 2 CO 3 + O 2 .
Застосування оксиду вуглецю
Монооксид вуглецю широко використовується як паливо у вигляді генераторного газу або водяного газу і утворюється також виділення багатьох металів з їх оксидів відновленням вугіллям. Генераторний газ одержують, пропускаючи повітря через розпечене вугілля. До його складу входить близько 25%, 4% СО2 і 70% N 2 зі слідами Н 2 і СН 4 62.
Застосування діоксиду вуглецю найчастіше зумовлене його фізичними властивостями. Його використовують як охолоджуючий агент, для газування напоїв, при отриманні полегшених (спінених) пластмас, а також як газ для створення інертної атмосфери.
Приклади розв'язання задач
ПРИКЛАД 1
ПРИКЛАД 2
| Завдання | Визначте у скільки разів важчий за повітря оксид вуглецю (IV)CO 2 . |
| Рішення | Відношення маси даного газу до маси іншого газу, взятого в тому ж обсязі, при тій же температурі і тому ж тиску, називається відносною щільністю першого газу по другому. Ця величина показує, у скільки разів перший газ важчий або легший за другий газ. Відносну молекулярну масу повітря приймають рівною 29 (з урахуванням вмісту в повітрі азоту, кисню та інших газів). Слід зазначити, що поняття «відносна молекулярна маса повітря» використовується умовно, оскільки повітря це суміш газів. D air(CO 2 ) = M r (CO 2 ) / M r (air); D air (CO 2 ) = 44/29 = 1,517. M r (CO 2 ) = A r (C) + 2×A r (O) = 12 + 2× 16 = 12 + 32 = 44. |
| Відповідь | Оксид вуглецю (IV)CO 2 важчий за повітря в 1,517 разів. |
З'єднань вуглецю. Оксид вуглецю (II)- чадний газ - з'єднання без запаху і кольору, горить блакитним полум'ям, легше за повітря і погано розчинний у воді.
СО- несолетворний оксид, але при пропусканні в розплав лугу при високому тиску утворює сіль мурашиної кислоти:
СО +KOH = HCOOK,
Тому СОчасто вважають ангідридом мурашиної кислоти:
HCOOH = CO + H 2 O,
Реакція протікає при дії концентрованої сірчаної кислоти.
Будова окиду вуглецю (II).
Ступінь окиснення +2. Зв'язок виглядає так:
Стрілкою показано додатковий зв'язок, який утворюється за донорно-акцепторним механізмом за рахунок неподіленої пари електронів атома кисню. Через це зв'язок в оксиді дуже міцна, тому оксид здатний вступати в реакції окислення-відновлення лише за високих температур.
Отримання оксиду вуглецю (II) .
1. Отримують його в ході реакції окиснення простих речовин:
2 C + O 2 = 2 CO,
C + CO 2 = 2 CO,
2. При відновленні СОсамим вуглецем чи металами. Реакція відбувається при нагріванні:
Хімічні властивості оксиду вуглецю (II).
1. У нормальних умовах оксид вуглецю не взаємодіє з кислотами та з основами.
2. У кисні повітря оксид вуглецю горить блакитним полум'ям:
2СО + Про 2 = 2СО 2,
3. При температурі оксид вуглецю відновлює метали з оксидів:
FeO + CO = Fe + CO 2
4. При взаємодії оксиду вуглецю з хлором утворюється отруйний газ - фосген. Реакція йде при опроміненні:
CO + Cl 2 = COCl 2,
5. Взаємодіє оксид вуглецю з водою:
CПро +H 2 O = CO 2 + H 2,
Реакція оборотна.
6. При нагріванні оксид вуглецю утворюється метиловий спирт:
CO + 2H 2 = CH 3 OH,
7. З металами оксид вуглецю утворює карбоніли(летючі сполуки).
Оксиди вуглецю
Останні роки у педагогічній науці віддається перевага особистісно орієнтованому навчанню. Формування індивідуальних якостей особистості відбувається у процесі діяльності: навчання, гри, праці. Тому важливим фактором навчання є організація процесу навчання, характер взаємин вчителя з учнями та учнів між собою. Виходячи з цих уявлень, я намагаюся особливим чином збудувати навчально-виховний процес. У цьому кожен учень обирає свій темп вивчення матеріалу, має можливість працювати доступному йому рівні, у ситуації успіху. На уроці вдається освоювати і вдосконалювати як предметні, а й такі загальнонавчальні вміння і навички, як постановка навчальної мети, вибір коштів та шляхів її досягнення, здійснення контролю над своїми досягненнями, корекція помилок. Учні навчаються працювати з літературою, складати конспекти, схеми, малюнки, працювати у групі, у парі, індивідуально, вести конструктивний обмін думками, логічно розмірковувати та робити висновки.
Проводити такі уроки непросто, але при успіху відчуваєш задоволення. Пропоную сценарій одного зі своїх уроків. На ньому були присутні колеги, адміністрація та психолог.
Тип уроку.Вивчення нового матеріалу.
Цілі.На основі мотивації та актуалізації опорних знань та навичок учнів розглянути будову, фізичні та хімічні властивості, отримання та застосування чадного та вуглекислого газів.
Статтю підготовлено за підтримки сайту www.Artifex.Ru. Якщо ви вирішили розширити свої знання у галузі сучасного мистецтва, то оптимальним рішенням стане відвідати сайт www.Artifex.Ru. Творчий альманах ARTIFEX дозволить вам, не виходячи з дому, ознайомитись із роботами сучасного мистецтва. Детальнішу інформацію ви зможете знайти на сайті www.Artifex.Ru. Ніколи не пізно починати розширювати свій кругозір та почуття прекрасного.
Обладнання та реактиви.Картки «Програмоване опитування», плакат-схема, прилади для одержання газів, склянки, пробірки, вогнегасник, сірники; вапняна вода, оксид натрію, крейда, соляна кислота, розчини індикаторів, H 2 SO 4 (конц.), HCOOH, Fe 2 O 3 .
Плакат-схема
«Будова молекула чадного газу (оксиду вуглецю(II)) СО»
ХІД УРОКУ
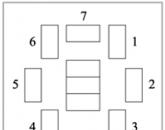
Столи для учнів у кабінеті розставлені по колу. Вчитель та учні мають можливість вільно пересісти за лабораторні столи (1, 2, 3). На урок діти сідають за навчальні столи (4, 5, 6, 7, …) один за одним за бажанням (вільні групи по 4 особи).

Вчитель. Мудре китайське прислів'я(записана красиво на дошці) говорить:
«Я чую – я забуваю,
Я бачу – я запам'ятовую,
Я роблю – розумію».
Ви погоджуєтесь з висновками китайських мудреців?
А які російські прислів'я відбивають китайську мудрість?
Діти наводять приклади.
Вчитель. Справді, лише творячи, творячи можна отримати цінний продукт: нові речовини, прилади, машини, і навіть нематеріальні цінності – висновки, узагальнення, висновки. Пропоную вам сьогодні взяти участь у дослідженні властивостей двох речовин. Відомо, що під час проходження технічного огляду автомобіля водій надає довідку про стан вихлопних газів автомобіля. Концентрація якого газу вказується у довідці?
(Відповідь СО.)
Учень. Цей газ отруйний. Потрапляючи у кров, він викликає отруєння організму («угоряння», звідси і назва оксиду – чадний газ). У кількостях, небезпечних для життя, він міститься у вихлопних газах автомобіля(зачитує повідомлення з газети про те, що пригорел насмерть водій, що заснув при працюючому двигуні в гаражі). Протиотрутою при отруєнні чадним газом служить вдихання свіжого повітря та чистого кисню. Іншим оксидом вуглецю є вуглекислий газ.
Вчитель. На ваших столах лежить картка «Програмоване опитування». Ознайомтеся з її змістом і на чистому листку позначте номери завдань, відповіді на які вам відомі на підставі вашого життєвого досвіду. Напроти номера завдання-ствердження напишіть формулу оксиду вуглецю, до якого належить це твердження.
Учні-консультанти (2 особи) збирають листи з відповідями та на основі результатів відповідей формують нові групи для подальшої роботи.
Програмоване опитування «Оксиди вуглецю»
1. Молекула цього оксиду складається з одного атома вуглецю та одного атома кисню.
2. Зв'язок між атомами в молекулі – ковалентний полярний.
3. Газ практично нерозчинний у воді.
4. У молекулі цього оксиду один атом вуглецю та два атоми кисню.
5. Запаху та кольору не має.
6. Газ розчинний у воді.
7. Не зріджується навіть при -190 ° С ( tкіп = -191,5 ° С).
8. Кислотний оксид.
9. Легко стискається, при 20 ° C під тиском 58,5 атм стає рідким, твердне в «сухий лід».
10. Чи не отруйний.
11. Несолетворний.
12. Горючий.
13. Взаємодіє із водою.
14. Взаємодіє із основними оксидами.
15. Реагує з оксидами металів, відновлюючи їх вільні метали.
16. Отримують взаємодією кислот із солями вугільної кислоти.
17. Отрута.
18. Взаємодіє зі лугами.
19. Джерело вуглецю, що засвоюється рослинами, у парниках та теплицях призводить до підвищення врожаю.
20. Використовується при газуванні води та напоїв.
Вчитель. Ознайомтеся ще раз із змістом картки. Згрупуйте інформацію в 4 блоки:
будова,
Фізичні властивості,
Хімічні властивості,
одержання.
Вчитель дає можливість виступити кожній групі учнів, узагальнює виступи. Потім учні різних груп обирають план роботи – порядок вивчення оксидів. З цією метою вони нумерують блоки інформації та обґрунтовують свій вибір. Черговість вивчення може бути такою, як записана вище, або з будь-якою іншою комбінацією зазначених чотирьох блоків.
Вчитель звертає увагу учнів на ключові моменти теми. Оскільки оксиди вуглецю є газоподібними речовинами, з ними потрібно поводитися обережно (правила техніки безпеки). Вчитель затверджує план кожної групи та розподіляє консультантів (заздалегідь підготовлених учнів).
Демонстраційні досліди
1. Переливання вуглекислого газу зі склянки на склянку.
2. Гасіння свічок у склянці в міру накопичення СО 2 .
3. У склянку з водою опустити кілька невеликих шматочків сухого льоду. Вода завирує, і з неї звалиться густий білий дим.
Газ СО 2 зріджується вже за кімнатної температури під тиском 6 МПа. У рідкому стані він зберігається та транспортується у сталевих балонах. Якщо відкрити вентиль такого балона, то рідкий СО 2 почне випаровуватися, внаслідок чого відбувається сильне охолодження і частина газу перетворюється на снігоподібну масу – сухий лід, який пресують і використовують для зберігання морозива.
4. Демонстрація вогнегасника хімічного пінного (ОХП) та пояснення принципу його роботи з використанням моделі – пробірки з пробкою та газовідвідною трубкою.

Інформація по будовоюза столом № 1 (інструкційні картки 1 та 2, будова молекул СО та СО 2).
Відомості про фізичні властивості– за столом № 2 (робота з підручником – Габрієлян О.С.Хімія-9. М: Дрофа, 2002, с. 134-135).
Дані про отримання та хімічні властивості– на столах № 3 та 4 (інструкційні картки 3 та 4, інструкція з проведення практичної роботи, с. 149–150 підручника).
Практична робота У пробірку внесіть кілька шматочків крейди або мармуру та прилийте трохи розведеної соляної кислоти. Швидко закрийте пробірку пробкою із газовідвідною трубкою. Кінець трубки опустіть в іншу пробірку, де знаходиться 2–3 мл вапняної води. Декілька хвилин спостерігайте, як через вапняну воду проходять бульбашки газу. Потім вийміть кінець газовідвідної трубки з розчину і промийте його в дистильованій воді. Опустіть трубку в іншу пробірку з 2-3 мл дистильованої води та пропустіть через неї газ. Через кілька хвилин вийміть трубку з розчину, додайте до отриманого розчину кілька крапель синього лакмусу. У пробірку налийте 2-3 мл розчину розведеного гідроксиду натрію і додайте до нього кілька крапель фенолфталеїну. Потім через розчин пропустіть газ. Дайте відповідь на питання. Запитання 1. Що відбувається, якщо на крейду чи мармур діють соляною кислотою? 2. Чому при пропусканні вуглекислого газу через вапняну воду спочатку відбувається помутніння розчину, а потім розчинення вапна? 3. Що відбувається при пропущенні оксиду вуглецю(IV) через дистильовану воду? Напишіть рівняння відповідних реакцій у молекулярному, іонному та скороченому іоном видах. Розпізнавання карбонатів У чотирьох пробірках, виданих вам, є кристалічні речовини: сульфат натрію, хлорид цинку, карбонат калію, силікат натрію. Визначте, яка речовина знаходиться у кожній пробірці. Складіть рівняння реакцій у молекулярному, іонному та скороченому іонному видах. |
Домашнє завдання
Вчитель пропонує взяти картку «Програмоване опитування» додому та під час підготовки до наступного уроку продумати способи отримання інформації. (Як ти дізнався, що газ, що вивчається, зріджується, взаємодіє з кислотою, отруйний і т.д.?)
Самостійна робота учнів
Практичну роботу групи дітей виконують із різною швидкістю. Тому тим, хто завершить роботу якнайшвидше, пропонуються ігри.
П'ятий зайвий
У чотирьох речовин можна знайти щось спільне, а п'ята речовина вибивається із ряду, зайве.
1. Вуглець, алмаз, графіт, карбід, карбін. (Карбід.)
2. Антрацит, торф, кокс, нафту, скло. (Скло.)
3. Вапняк, крейда, мармур, малахіт, кальцит. (Малахіт.)
4. Кристалічна сода, мармур, поташ, каустик, малахіт. (Каустик.)
5. Фосген, фосфін, синильна кислота, ціанід калію, сірковуглець. (Фосфін.)
6. Морська вода, мінеральна вода, дистильована вода, ґрунтова вода, тверда вода. (Дистильована вода.)
7. Вапняне молоко, пушонка, гашене вапно, вапняк, вапняна вода. (Вапняк.)
8. Li 2 3 ; (NH 4) 2 CO 3; СаСО 3; K 2 CO 3 , Na 2 CO 3 . (CaCO 3 .)
Синоніми
Напишіть хімічні формули речовин чи їх назви.
1. Галоген – … (Хлор чи бром.)
2. Магнезит – … (MgCO 3 .)
3. Сечовина – … ( Карбамід H 2 NC(O)NH 2 .)
4. Поташ - … (K 2 CO 3 .)
5. Сухий лід – … (CO 2 .)
6. Оксид водню – … ( Вода.)
7. Нашатирний спирт - ... ( 10% водний розчин аміаку.)
8. Солі азотної кислоти – … ( Нітрати– KNO 3 , Ca(NO 3) 2 , NaNO 3 .)
9. Природний газ – … ( Метан CН 4 .)
Антоніми
Напишіть хімічні терміни, протилежні за запропонованим значенням.
1. Окислювач – … ( Відновлювач.)
2. Донор електронів – … ( Акцептор електрони.)
3. Кислотні властивості – … ( Основні властивості.)
4. Дисоціація – … ( Асоціація.)
5. Адсорбція – … ( Десорбція.)
6. Анод – … ( Катод.)
7. Аніон – … ( Катіон.)
8. Метал – … ( Неметал.)
9. Вихідні речовини – … ( Продукти реакції.)
Пошук закономірностей
Встановіть ознаку, що поєднує вказані речовини та явища.
1. Алмаз, карбін, графіт - ... ( Алотропні модифікації вуглецю.)
2. Скло, цемент, цегла – … ( Будівельні матеріали.)
3. Дихання, гниття, виверження вулкана - ... ( Процеси, що супроводжуються виділенням вуглекислого газу.)
4. СО, 2, СН 4, SiH 4 - ... ( Сполуки елементів IV групи.)
5. NaHCO 3 , CaCO 3 , CO 2 , H 2 CO 3 - … ( Кисневі сполуки вуглецю.)
Про те, наскільки небезпечний чадний газ для людини, знають усі, кому доводилося стикатися з роботою опалювальних систем, — печей, котлів, бойлерів, водогрійних колонок, розрахованих на побутове паливо у будь-якій його формі. Нейтралізувати його в газовому стані досить складно, ефективних домашніх способів боротися з чадним газом не існує, тому більшість захисних заходів спрямована на попередження і своєчасне виявлення чаду в повітрі.
Властивості токсичної речовини
У природі та властивостях чадного газу немає нічого незвичайного. По суті, це продукт часткового окислення вугілля або вугільних видів палива. Формула чадного газу проста і нехитра - СО, в хімічних термінах - монооксид вуглецю. Один атом вуглецю з'єднаний із атомом кисню. Так влаштована природа процесів горіння органічного палива, що чадний газ є невід'ємною частиною будь-якого полум'я.

Вугілля, споріднені з ним види палива, торф, дрова при нагріванні в топці газифікуються в чадний газ, і тільки потім допалюються припливом повітря. Якщо чад просочився з камери горіння в приміщення, то він залишатиметься в стабільному стані до моменту, коли вентиляцією чадний потік буде винесений з кімнати або накопичуватися, заповнюючи весь простір від підлоги до стелі. В останньому випадку врятувати положення може лише електронний датчик чадного газу, який реагує на найменше підвищення концентрації токсичного чаду в атмосфері приміщення.
Що необхідно знати про чадний газ:
- У стандартних умовах щільність чадного газу - 1,25 кг/м3, що дуже близько до питомої ваги повітря 1,25 кг/м3. Гарячий і навіть теплий монооксид легко піднімається під стелю, у міру остигання осідає і перемішується з повітрям;
- Чадний газ не має смаку, кольору та запаху, навіть в умовах високої концентрації;
- Для початку утворення чадного газу достатньо нагріти метал, що контактує з вуглецем, до температури 400-500 про С;
- Газ здатний горіти у повітрі з виділенням великої кількості тепла, приблизно 111 кДж/моль.
Небезпечним є не тільки вдихання чадного газу, газоповітряна суміш здатна вибухати при досягненні об'ємної концентрації від 12,5% до 74%. У цьому сенсі газова суміш схожа на побутовий метан, але набагато небезпечніший за мережевий газ.

Метан легший за повітря і менш токсичний при вдиханні, крім того, завдяки додаванню до газового потоку спеціальної присадки – меркаптану, його наявність у приміщенні легко вловити по запаху. При невеликій загазованості кухні можна без наслідків для здоров'я увійти в приміщення і провітрити його.
З чадним газом все складніше. Близька спорідненість ЗІ та повітря перешкоджає ефективному видаленню токсичної газової хмари. У міру охолодження хмара газу поступово осідатиме в області підлоги. Якщо спрацював датчик чадного газу, або виявився витік продуктів горіння з печі або котла на твердому паливі, необхідно негайно вживати заходів до провітрювання, інакше першими постраждають діти та домашні вихованці.
Подібна властивість чадної хмари раніше широко використовувалася для боротьби з гризунами і тарганами, але ефективність газової атаки значно нижча за сучасні засоби, а ризик заробити отруєння незрівнянно вище.
До відома! Газова хмара СО, за відсутності вентиляції, здатна зберігати свої властивості без змін тривалий час.
За наявності підозри у накопиченні чадного газу в підвальних приміщеннях, підсобках, котельнях, льохах насамперед необхідно забезпечити максимальне провітрювання з кратністю газообміну 3-4 одиниці протягом години.
Умови появи чаду в приміщенні
Монооксид вуглецю можна отримати за допомогою десятків варіантів хімічних реакцій, але для цього необхідні специфічні реактиви та умови їхньої взаємодії. Ризик заробити отруєння газом у такий спосіб практично дорівнює нулю. Основними причинами появи чадного газу в котельні або в приміщенні кухні залишаються два фактори:
- Погана тяга та часткове перетікання продуктів горіння з вогнища горіння до приміщення кухні;
- Неправильна експлуатація котельного, газового та пічного обладнання;
- Пожежі та локальні осередки займання пластику, проводки, полімерних покриттів та матеріалів;
- Гази, що відходять з каналізаційних комунікацій.
Джерелом чадного газу може стати вторинне горіння золи, пухких відкладень сажі в димарях, кіптява і смола, що в'їлися в цегляну кладку камінних полиць і сажогасників.

Найчастіше джерелом газового ЗІ стають вугілля, що тліє, догоряють в топці при закритій засувці. Особливо багато виділяється газу при термічному розкладанні дров без повітря, приблизно половину газової хмари займає чадний газ. Тому будь-які експерименти з копченням м'яса та риби на серпанку, що отримується від тліючої стружки, повинні виконуватися тільки на відкритому повітрі.
Незначна кількість чадного газу може з'являтися і в процесі приготування їжі. Наприклад, усі, хто стикався з установкою на кухні газових опалювальних котлів із закритою топкою, знають, як реагують датчики чадного газу на смажену картоплю чи будь-які продукти, приготовані в киплячому маслі.

Підступний характер чадного газу
Головна небезпека монооксиду вуглецю полягає в тому, що неможливо відчути та відчути його присутність в атмосфері приміщення до того моменту, як газ потрапить з повітрям до органів дихання та розчиниться у крові.

Наслідки від вдихання ЗІ залежать від концентрації газу в повітрі та тривалості перебування у приміщенні:
- Головний біль, нездужання та розвиток сонливого стану починається при об'ємному вмісті газу в повітрі 0,009-0,011%. Фізично здорова людина здатна витримати до трьох годин перебування у загазованій атмосфері;
- Нудота, сильний біль у м'язах, судоми, непритомність, втрата орієнтації можуть розвинутися при концентрації 0,065-0,07%. Час перебування у приміщенні досі настання невідворотних наслідків всього1,5-2 год;
- При концентрації чадного газу вище 0,5%, навіть кілька секунд перебування в загазованому просторі означають летальний кінець.

Навіть якщо людина благополучно самостійно вибралася з приміщення з високою концентрацією чадного газу, все одно знадобиться медична допомога та використання антидотів, оскільки наслідки отруєння кровоносної системи та порушення кровообігу мозку все одно виявляться, лише трохи пізніше.
Молекули чадного газу добре поглинаються водою та сольовими розчинами. Тому як перший підручний засіб захисту нерідко використовуються звичайні рушники, серветки, змочені будь-якою доступною водою. Це дозволяє зупинити попадання чадного газу в організм на кілька хвилин, доки з'явиться можливість залишити приміщення.
Нерідко цією властивістю монооксиду вуглецю зловживають деякі власники опалювальної апаратури, в якій вбудовані датчики. При спрацьовуванні чутливого сенсора замість провітрювання приміщення часто прилад просто накривають мокрим рушником. Як результат, після десятка подібних маніпуляцій датчик чадного газу виходить з ладу, і на порядок зростає ризик заробити отруєння.
Технічні системи реєстрації чадного газу
По суті, сьогодні існує лише один спосіб успішно боротися з чадним газом, використовувати спеціальні електронні прилади та датчики, що реєструють перевищення концентрації СО у приміщенні. Можна, звичайно, зробити простіше, наприклад, облаштувати потужну вентиляцію, як це роблять любителі відпочинку біля справжнього цегляного каміна. Але в подібному рішенні є певний ризик заробити отруєння чадним газом при зміні напрямку тяги в трубі, а крім того, жити під сильним протягом теж не дуже корисно здоров'ю.

Влаштування датчиків наявності чадного газу
Проблема контролю за вмістом чадного газу в атмосфері житлових та підсобних приміщень на сьогодні настільки ж злободенно, як і наявність пожежної чи охоронної сигналізації.
У спеціалізованих салонах опалювального та газового обладнання можна придбати кілька варіантів приладів контролю за вмістом газу:
- хімічні сигналізатори;
- Інфрачервоні сканери;
- Твердотільні датчики.
Чутливий сенсор приладу зазвичай комплектується електронною платою, що забезпечує живлення, калібрування та перетворення сигналу на зрозумілу форму індикації. Це можуть бути просто зелені та червоні світлодіоди на панелі, звукова сирена, цифрова інформація для видачі сигналу в комп'ютерну мережу або імпульс для автоматичного клапана, що перекриває подачу побутового газу до опалювального котла.

Зрозуміло, що використання датчиків з керованим замикаючим клапаном є вимушеним заходом, але найчастіше виробники опалювального обладнання навмисно вбудовують захист від дурня, щоб уникнути всіляких маніпуляцій з безпекою газового обладнання.
Хімічні та твердотільні прилади контролю
Найбільш дешева та доступна версія датчика з хімічним індикатором виготовляється у вигляді сітчастої колби, що легко проникне для повітря. Усередині колби знаходиться два електроди, розділені пористою перегородкою, просоченою розчином лугу. Поява чадного газу призводить до карбонізації електроліту, провідність сенсора різко падає, що негайно зчитується електронікою як сигнал тривоги. Після встановлення прилад знаходиться в неактивному стані і не спрацьовує доти, доки в повітрі не з'являться сліди чадного газу, що перевищують допустиму концентрацію.
У твердотільних датчиках замість просоченого лугом шматка азбесту використовуються двошарові пакети з діоксидів олова та рутенію. Поява газу в повітрі викликає пробій між контактами сенсорного пристрою та автоматично запускає сигнал тривоги.

Сканери та електронні сторожа
Інфрачервоні датчики, що працюють за принципом сканування навколишнього повітря. Вбудований інфрачервоний сенсор сприймає світіння лазерного світлодіода, і зміни інтенсивності поглинання газом теплового випромінювання спрацьовує тригерное пристрій.

СО дуже добре поглинає теплову частину спектра, тому подібні прилади працюють у режимі сторожа чи сканера. Результат сканування може видаватися у вигляді двоколірного сигналу або індикації величини вмісту чадного газу повітря на цифровій або лінійній шкалі.
Який датчик краще
Для правильного підбору сенсора наявності чадного газу необхідно враховувати режим роботи та характер приміщення, в якому необхідно встановити сенсорний пристрій. Наприклад, хімічні датчики, які вважаються застарілими, чудово працюють в умовах котелень та підсобних приміщень. Недорогий прилад для виявлення чадного газу можна встановити на дачі або майстерні. На кухні сітка швидко покривається пилом та жировими відкладеннями, що різко знижує чутливість хімічної колбочки.
Напівпровідникові сенсори чадного газу працюють однаково добре в будь-яких умовах, але для їх функціонування потрібне потужне зовнішнє джерело живлення. Вартість приладу вища за ціну на хімічні сенсорні системи.

Інфрачервоні датчики сьогодні найбільш поширені. Вони активно використовують для комплектації систем безпеки квартирних котлів індивідуального опалення. При цьому чутливість системи контролю практично не змінюється з часом через пил або температуру повітря. Мало того, такі системи, як правило, мають вбудовані механізми тестування та калібрування, що дозволяє періодично перевіряти їхню працездатність.
Встановлення приладів контролю за вмістом чадного газу
Сенсори, які здійснюють контроль за вмістом чадного газу, повинні встановлюватися та обслуговуватися виключно профільними фахівцями. Періодично прилади підлягають перевірці, калібруванні, обслуговуванню та заміні.

Датчик повинен встановлюватися на відстані від джерела газу від 1 до 4 м, корпус або виносні сенсори кріпляться на висоті 150 см над рівнем підлоги і обов'язково калібруються по верхньому і нижньому порозі чутливості.
Термін служби квартирних датчиків чадного газу становить 5 років.
Висновок
Боротьба з утворенням чадного газу вимагає акуратності та відповідального ставлення до встановленої апаратури. Будь-які експерименти з сенсорами, особливо напівпровідникового типу, різко знижують чутливість приладу, що зрештою призводить до збільшення вмісту чадного газу в атмосфері кухні та всієї квартири, повільному отруєнню всіх її мешканців. Проблема контролю чадного газу є настільки серйозною, що, можливо, використання сенсорів у майбутньому можуть зробити обов'язковим для всіх категорій індивідуального опалення.
Зміст
Ознаки того, що чадний газ (оксид вуглецю(II), окис вуглецю, монооксид вуглецю) утворився в повітрі у небезпечній концентрації, визначити складно – невидимий, може не пахнути, накопичується в приміщенні поступово, непомітно. Для життя людини надзвичайно небезпечний: має високу токсичність, зайве утримання в легенях призводить до важких отруєнь і смертельних наслідків. Щорічно фіксується високий рівень смертності від отруєння газом. Зменшити загрозу отруєння можна дотриманням простих правил та використанням спеціальних датчиків чадної речовини.
Що таке чадний газ
Природний газ утворюється при горінні будь-якої біомаси, у промисловості є продуктом горіння будь-яких сполук на основі вуглецю. І в тому, і в іншому випадку обов'язковою умовою виділення газу є нестача кисню. Великі обсяги його надходять в атмосферу внаслідок лісових пожеж у вигляді вихлопних газів, що утворюються при згорянні палива в двигунах автомобілів. У промислових цілях використовується при виробництві органічного спирту, цукру, обробці м'яса тварин та риби. Невелика кількість монооксиду виробляють клітини організму людини.
Властивості
З погляду хімії monoxide – неорганічна сполука з єдиним атомом кисню у молекулі, хімічна формула – СО. Це хімічна речовина, яка не має характерного кольору, смаку та запаху, вона легша за повітря, але важча за водень, при кімнатних температурах неактивна. Людина, що відчуває запах, відчуває лише присутність органічних домішок, що знаходяться в повітрі. Належить до розряду токсичних продуктів, смерть при концентрації повітря 0,1% настає протягом однієї години. Характеристика гранично допустимої концентрації дорівнює 20 мг/куб.
Дія чадного газу на організм людини
Для людини монооксид вуглецю становить смертельну небезпеку. Його токсична дія пояснюється утворенням у клітинах крові карбоксигемоглобіну – продукту приєднання оксиду вуглецю (II) до гемоглобіну крові. Високий рівень вмісту карбоксигемоглобіну викликає кисневе голодування, недостатнє надходження кисню до головного мозку та інших тканин організму. При слабкій інтоксикації вміст його в крові низький, руйнування природним шляхом можливе протягом 4-6 годин. При високих концентраціях діють лише медичні препарати.
Отруєння чадним газом
Окис вуглецю – одна з найнебезпечніших речовин. При отруєнні відбувається інтоксикація організму, що супроводжується погіршенням загального стану людини. Дуже важливо вчасно розпізнати ознаки отруєння чадним газом. Результат лікування залежить від рівня речовини в організмі і від того, коли прийшла допомога. У цій справі рахунок йде на хвилини – постраждалий може або вилікуватися остаточно, або залишитися хворим назавжди (залежить від швидкості реагування рятувальників).
Симптоми
Залежно від ступеня отруєння можуть спостерігатися головний біль, запаморочення, шум у вухах, прискорене серцебиття, нудота, задишка, мерехтіння в очах, загальна слабкість. Часто спостерігається сонливість, що особливо небезпечно, коли людина перебуває у загазованому приміщенні. При попаданні до органів дихання великої кількості отруйних речовин спостерігаються судоми, втрата свідомості, особливо важких випадках – кома.

Перша допомога при отруєнні чадним газом
Потерпілому на місці має бути надана долікарська допомога при отруєнні чадним газом. Потрібно негайно перемістити його на свіже повітря і викликати лікаря. Слід пам'ятати і про свою безпеку: заходити в приміщення з джерелом цієї речовини треба лише глибоко вдихнувши, не дихати всередині. Поки не приїхав лікар, треба полегшити доступ кисню до легень: розстебнути гудзики, зняти або послабити одяг. Якщо потерпілий знепритомнів і перестав дихати, необхідна штучна вентиляція легень.
Антидот при отруєнні
Спеціальна протиотрута (антидот) при отруєнні окисом вуглецю – це медикаментозний препарат, який активно перешкоджає утворенню карбоксигемоглобіну. Дія антидоту призводить до зниження потреби організму в кисні, підтримці органів, чутливих до нестачі кисню: головного мозку, печінки та ін. Вводиться внутрішньом'язово дозуванням 1 мл відразу після вилучення хворого із зони з високою концентрацією отруйних речовин. Повторно можна вводити антидот не раніше, ніж через годину після першого введення. Дозволяється його використання для профілактики.
Лікування
У разі легкої дії окисом вуглецю лікування проводиться амбулаторно, у тяжких випадках хворий госпіталізується. Вже в кареті швидкої допомоги йому надається киснева подушка або маска. У важких випадках, щоб дати організму велику дозу кисню, пацієнта поміщають у барокамеру. Внутрішньом'язово вводиться антидот. Рівень газу у крові постійно контролюється. Подальша медикаментозна реабілітація, дії лікарів спрямовані на відновлення роботи головного мозку, серцево-судинної системи, легень.

Наслідки
Вплив чадним вуглецем на організм може стати причиною серйозних захворювань: змінюються працездатність мозку, поведінка, свідомість людини, з'являються незрозумілі головні болі. Особливо впливу шкідливих речовин схильна до пам'яті - та частина головного мозку, яка відповідає за перехід короткочасної пам'яті в довготривалу. Наслідки отруєння чадним газом хворий може відчути лише за кілька тижнів. Більшість постраждалих повністю відновлюються після періоду реабілітації, але дехто відчуває наслідки все життя.
Як визначити чадний газ у приміщенні
Отруїтися окисом вуглецю легко в домашніх умовах, і це трапляється не лише під час пожежі. Концентрація чадного вуглецю утворюється при неакуратному поводженні із заслінкою печі, експлуатації несправної газової колонки або вентиляції. Джерелом чадної речовини може бути газова плита. Якщо у приміщенні стоїть дим – це вже привід бити на сполох. Для постійного контролю над рівнем газу існують спеціальні датчики. Вони контролюють рівень концентрації газу та повідомляють про перевищення норми. Наявність такого приладу знижує ризик отруєння.
Відео
Увага!Інформація представлена у статті має ознайомлювальний характер. Матеріали статті не закликають до самостійного лікування. Тільки кваліфікований лікар може поставити діагноз і дати рекомендації щодо лікування, виходячи з індивідуальних особливостей конкретного пацієнта.
Знайшли у тексті помилку? Виділіть її, натисніть Ctrl+Enter і ми все виправимо!Популярне
- Амперсанд? - А що це? & Як називається цей знак? Як пишеться амперсанд
- Історія появи Homo sapiens
- Wanna, Gonna та інші скорочення в англійській мові
- Історія святого Князя Володимира та його однієї з подружжя, княжни Рогенди Чи було кохання
- Садовий городній календар на жовтень
- На якому місяці треба тархун посадити
- Новий рік для найменших
- Дикорослі рослини: види, назви, на відміну від культурних
- Прикмети, повір'я, звичаї, обряди та ворожіння на Водохреща Забобони на хрещення 19 січня
- Веселі новорічні сценки для корпоративної вечірки (для дорослих) У гостях у казки новорічна сценка корпоратив