Кораксан інструкція та опис до лікарського препарату. Інгібітори I f-каналів Електрофізіологічні властивості кардіоміоцитів
Триметазидин (предуктал МВ) - міокардіальний цитопротектор, що оптимізує енергетичний обмін кардіоміоцитів в умовах ішемії міокарда за рахунок пригнічення бета-окислення жирних кислот. Забезпечує антиангінальний і антиішемічний ефекти. Може застосовуватися в якості додаткового засобу і в комбінації з іншими антиангінальними препаратами.
Івабрадін (Кораксан) - виборчий і специфічний інгібітор If-каналів сино-атріального з'єднання, що володіє антиишемическим і антиангінальну ефектом завдяки зниженню ЧСС. Застосовується для контролю за рівнем ЧСС у пацієнтів з синусовим ритмом при неможливості або неефективності бета-блокаторів та інших антиангінальних препаратів.
Ключові слова: триметазидин, модифіковане вивільнення (МВ), антиангінальний, антиішемічний ефекти, If-кана- ли, Кораксан.
Антиангінальних препаратів метаболічного ДІЇ (триметазидин)
В останні роки спостерігається помітний інтерес до метаболічного напрямку в лікуванні стабільної стенокардії. Застосування антиангінальних і антиішемічних препаратів метаболічної дії дозволяє уникнути несприятливих наслідків при призначенні або збільшенні доз антиангінальних препаратів гемодинамічної дії (нітровазоділататорамі, блокаторів бетаадренорецептори, блокаторів повільних кальцієвих каналів).
Механізм дії триметазидину
Антиангінальний, антіішеміческійіцітопротектівнийеффект триметазидину визначається (опосередковується) оптимізацією енергетичного обміну кардіоміоцитів в умовах ішемії міокарда.
Міокард отримує енергію у вигляді молекул аденозинтрифосфату (АТФ), які синтезуються безпосередньо в кардіоміоцитах через окислення енергетичних субстратів в мітохондріях. Витрата АТФ в кардіоміоцитах динамічно урівноважений його синтезом; без відтворення запасів АТФ в кардіоміоциті вистачає тільки на кілька серцевих скорочень. Основними енергетичними субстратами для кардіоміоцитів є довголанцюгові жирні кислоти (ЖК), глюкоза і лактат (2/3 АТФ синтезуються з ЖК, 1/3 - з глюкози і лактату). У кардіміоцітах глюкоза піддається ферментативним гліколітичні реакцій з утворенням молекул АТФ, що підтримують градієнт іонів (іонної стабільності) і цілісності клітинної мембрани при ішемії, або, з утворенням пірувату, що вимагає для метаболізму меншого споживання кисню, ніж ЖК.
Посилення окислення ЖК, гальмує окислення пірувату в мітохондріях кардіоміоцитів, лежить в основі зниження способнос-
ти міокарда протистояти ішемічним пошкодження клітин. Накопичення ЖК і їх метаболітів в кардіоміоцитах при гіпоксії надає цитотоксические ефекти на клітинні мембрани. Надмірна кількість ЖК роз'єднує окисне фосфорилювання в мітохондріях, додатково знижуючи синтез АТФ, порушує скоротність клітин і викликає незворотні структурні зміни.
Часткове перемикання метаболізму з використання міокарда в якості енергетичного субстрату ЖК на глюкозу захищає кардіоміоцити від ішемічного пошкодження і покращує ефективність роботи серця. Лікарські засоби, здатні обмежити використання РК на користь окислення глюкози, отримали назву цитопротективний антиішемічних антиангінальних препаратів з метаболічним механізмом дії.
Триметазидин є частковим інгібітором бета-окислення ЖК, селективно зменшує активність ДЦ 3-кетоацил КоА тіолази - ферменту б ета-окислення ЖК.
ефекти триметазидину
Застосування триметазидину достовірно знижує частоту нападів стенокардії, збільшує час виконуваної навантаження, час навантаження до появи депресії сегмента ST,тривалість пікового навантаження як при монотерапії, так і в комбінації з іншими антиангінальними засобами.
Збільшення коронарного резерву хворих на ІХС відзначається після 15-го дня регулярного прийому препарату.
Одночасне застосування пропранололу, як гемодинамического антиангінальний препарат, з триметазидином було ефективніше, ніж застосування пропранололу з ізосорбіду динітрату, - двох гемодинамічних антиангінальних препаратів на число ангінозних нападів і переносимість навантажувального тесту.
Додатковий антіангіанльний ефект триметазидину зберігається при тривалому регулярному застосуванні, забезпечуючи хорошу переносимість та поліпшення якості життя.
Повідомляються дані про відновлення функції гібернірующего міокарда, що може бути використано для пацієнтів, які не підлягають ангіопластики, або відсутності можливості хірургічного лікування при ІХС.
У пацієнтів ХСН застосування триметазидину приводило до поліпшення скоротливості міокарда, збільшення фракції викиду лівого шлуночка як в спокої, так і на піку фармакологічної навантаження, зниження функціонального класу стенокардії і ХСН, збільшення дистанції 6-хвилинної ходьби.
Триметазидин має 2 лікарські форми: форму зі звичайним вивільненням і форму з модифікованим (уповільненим) вивільненням (предуктал МВ). Предуктал МВ має фармакокинетическими і клінічними перевагами перед звичайною лікарською формою триметазидину, забезпечуючи додатковий антиангінальний і антиішемічний ефекти протягом доби з контролем ішемії ранніх ранкових годин.
Фармакокінетичніпараметри модифікованої форми вивільнення триметазидину - предуктала МВ
Модифікована форма вивільнення триметазидину лікарської форми предуктала МВ дозволяє підтримувати терапевтичну концентрацію активної речовини протягом 11 год на рівні 75% від максимальної, що дозволяє застосовувати препарат 2 рази на день для підтримки більш стабільної концентрації триметазидину протягом доби в порівнянні з формою звичайного вивільнення активної речовини . Гідрофільний матрикс лікарської форми предуктала МВ при контакті з рідиною шлунково-кишкового тракту після набрякання перетворюється в гель, який формує своєрідний бар'єр, який контролює вивільнення триметазидину і забезпечує рівномірність і тривалість дії препарату. Біодоступність препарату не залежить від прийому їжі. Стабільна концентрація активної речовини досягається через 2-3 дні після початку регулярного прийому препарату.
Обсяг розподілу препарату становить 4,8 л / кг, що передбачає хорошу дифузію триметазидину в тканини. Зв'язування з білками сироватки крові - низький, що забезпечує безпеку комбінованої терапії з іншими класами фармакологічних засобів. Лікарська взаємодія триметазидину не описано.
Триметазидин виводиться в основному нирками в незміненому вигляді. Період напіввиведення становить 7 год, збільшується до 12 год у пацієнтів старше 65 років. Нирковий кліренс триметазидину прямо корелює з кліренсом креатиніну.
Печінковий кліренс знижується з віком. Препарат не рекомендується пацієнтам з нирковою недостатністю з кліренсом креатиніну менше 15 мл / хв, а також пацієнтам з вираженими порушеннями функції печінки.
В даний час про випадки передозування препарату не повідомлялося.
Тератогенну дію в експериментальних дослідженнях не встановлено.
Триметазидин не впливає на здатність до водіння автомобіля і виконання робіт, що вимагають високої швидкості психомоторних реакцій.
Показання до застосування триметазидину
Предуктал МВ є найбільш вивченим препаратом з доведеним антиангінальним і антиішемічний дією.
В даний час це єдиний міокардіальний цитопротектор, рекомендований експертами кардіологічних товариств Росії, Європи, Америки для лікування стенокардії. Згідно Російським рекомендацій препарат може бути призначений на будь-якому етапі терапії стабільної стенокардії для посилення антиангінальної ефективності бета-блокаторів, антагоністів кальцію і нітратів всім хворим стабільною стенокардією напруги.
При неможливості призначення антиангінальних класів препаратів гемодинамічної дії (бета-блокаторів, антагоністів кальцію і нітратів) триметазидин може мати місце в лікуванні стенокардії в поєднанні з івабрадином, а в разі неможливості призначення антиангінальних препаратів інших класів - препаратом монотерапії.
Найбільш обгрунтовані ситуації застосування предуктала МВ в лікування хворих стабільною стенокардією:
Недостатня ефективність традиційних антиангінальних препаратів;
Погана переносимість традиційних антиангінальних препаратів або наявність протипоказань до їх застосування;
Цукровий діабет;
Хронічна серцева недостатність.
Цукровий діабет - важливий фактор ризику інфаркту міокарда та раптової смерті у хворих на ішемічну хворобу серця і без неї. При цукровому діабеті метаболізм в м'язах і серце зміщується в бік утилізації жирних кислот, обмежується утилізація глюкози, що призводить до зниження ефективності скорочення м'язової тканини і стійкості до ішемії. Обмеження окислення жирних кислот і стимуляція утилізації глюкози при застосуванні триметазидину відновлює рівновагу між гликолизом і окисленням глюкози, збільшує утворення АТФ в умовах обмеженого споживання кисню у хворих на цукровий діабет.
Побічні дії тіметазідіна і протипоказання
Рідко - нудота, блювота, можливі алергічні реакції.
Препарат протипоказаний при вагітності через відсутність клінічних даних про безпеку його застосування.
Невідомо, чи виділяється триметазидин з грудним молоком, тому препарат не рекомендується в період лактації.
СПЕЦИФІЧНИЙ ІНГІБІТОР IF-КАНАЛІВ сино-Тріальні З'ЄДНАННЯ (івабрадином)
Івабрадін (Кораксан) - виборчий і специфічний інгібітор If-каналів сино-атріального з'єднання з антиишемическим і антиангінальну ефектом, обумовленим зниженням частоти серцевих скорочень.
Підвищення частоти серцевих скорочень в значній мірі збільшує потребу міокарда в кисні і посилення міокардіального кровотоку у пацієнтів з ішемічною хворобою серця. Великі епідеміологічні дослідження підтверджують роль високою ЧСС спокою як суворого предиктор загальної та серцево-судинної смертності в групах здорових людей, у пацієнтів з артеріальною гіпертонією, болно з метаболічним синдромом, літніх і пацієнтів з ішемічною хворобою серця. Застосування бета-блокаторів у пацієнтів, які перенесли інфаркт міокарда, виявило безперечну перевагу зниження ЧСС в зменшенні смертності у цієї групи.
Електрофізіологічні властивості кардіоміоцитів
Частота серцевих скорочень визначає:
Споживання кисню міокардом і ішемічний поріг міокарда;
Час діастолічного наповнення коронарних артерій і час коронарного кровотоку;
Підвищений симпатическое вплив катехоламінів, що збільшують поріг фібриляції шлуночків, що може призводити до підвищення серцево-судинної захворюваності та смертності;
Проатерогенного дію.
Висока частота серцевих скорочень як фактор низького рівня фізичного розвитку або поганого загального стану здоров'я супроводжується більш високим рівнем коронарної, серцево-судинної смертності і раптової смерті асоціюється з підвищенням смертності у пацієнтів з ішемічною хворобою серця, підтвердженим інфарктом міокарда, у літніх пацієнтів.
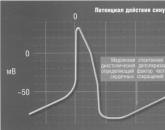
У механізмі скорочення кардіоміоцитів або генеруванні імпульсів спеціалізованими пейсмекерного клітинами синусового вузла визначальним є зміна потенціалу між внутрішньою і зовнішньою поверхнею клітинної мембрани - минуща деполяризация мембран клітин потенціалу дії.
В умовах спокою кардіоміоцити перебувають в стані поляризації, маючи постійну різницю електричного потенціалу між внутрішньою і зовнішньою поверхнею клітинної мембрани - трансмембранний потенціал спокою. Трансмембранний потенціал спокою, що становить приблизно -90 мВ, підтримується, як і потенціал дії, іонними цитоплазматическими струмами іонного Na-K насоса через мембрани клітин і міжклітинні з'єднання.
Деполяризація клітини виникає при надходженні позитивно заряджених іонів всередину клітини, триває до врівноваження електрохімічного градієнта і визначає потенціал дії, що переміщається по провідних шляхах і на рівні міокардіальних клітин стимулюючий м'язове скорочення.
У електрофізіологічне стані кардіоміоцитів виділяють фази швидкої деполяризації, швидкої реполяризації, плато, повільної реполяризації, що відносяться до потенціалу дії, і фазу потенціалу спокою (рис. 17.1). У спеціалізованих клітинах серця, що володіють пейсмекерного властивостями, фаза повільної
реполяризації переходить в фазу спонтанної діастолічної (пейсмекерной) деполяризації, яка доводить мембранний потенціал до порогового напруги, в результаті чого запускається потенціал дії (рис. 17.2). Спонтанна діастолічна деполяризація виникає за рахунок дії іонного Na-K-насоса, де потік позитивно заряджених іонів всередину клітини визначає діастолічний зміна деполяризації.
Механізм дії КОРАКСАН
Івабарадін (Кораксан)- представник нового класу препаратів, вибірково і специфічно інгібує If-канали синоатриального з'єднання, антиишемический і антиангінальний результат якого обумовлений ефектом зниження частоти серцевих скорочень.
При підтримці мембранного потенціалу на рівні -35 мВ, т. Е. При закритих If-каналах, зв'язування КОРАКСАН з клітинами синусового вузла не відбувається. Здатність пригнічувати f-канали відбувається при більш негативному значенні трансмембранного потенціалу, коли канал перебуває у відкритому стані. В такому випадку Кораксан здатний досягти зв'язує ділянки, розташованої усередині пори f-каналу, придушити If-ток і забезпечити ефективне зниження частоти серцевих скорочень.
Мал. 17.1.Електрофізіологія кардіоміоцитів. 0 - фаза швидкої деполяризації, 1 - фаза швидкої реполяризації, 2 - фаза плато, 3 - фаза повільної реполяризації, 4 - фаза потенціалу спокою
 Мал. 17.2.Потенціал дії клітин синусового вузла
Мал. 17.2.Потенціал дії клітин синусового вузла
Специфічне властивість зв'язування КОРАКСАН з відкритими f-каналами визначило концепцію «залежною терапевтичної корисності»:
Рівень зв'язування КОРАКСАН залежить від рівня відкриття f-каналів і частоти серцевих скорочень;
Ефективність КОРАКСАН зростає при більшій частоті серцевих скорочень.
Кораксан зменшує амплітуду If-струмів в залежності від концентрації.
Діючи на рівні синусового вузла, вибірково пригнічуючи іонні If-токі відкритих If-каналів, Кораксан знижує швидкість спонтанної діастолічної деполяризації без зміни максимального діастолічного потенціалу, збільшуючи інтервал часу між потенціалами дії і знижуючи частоту серцевих скорочень в залежності від ступеня її вираженості і пропорційно концентрації активного речовини.
У концентрації КОРАКСАН, в 100 разів перевищує терапевтичну (10 мк / моль), зазначалося легке зниження активності кальцієвих каналів L-типу, що не приводить до значного пригнічення струму іонів кальцію. Ці дані дозволяють припустити відсутність негативного інотропного ефекту КОРАКСАН на сокра-
тітельную функцію міокарда, однак для застосування КОРАКСАН у хворих з систолічною дисфункцією міокарда необхідні додаткові клінічні підтвердження.
Вплив КОРАКСАН на кальцієві канали Т-типу в формуванні потенціалу дії синусового вузла виявлено не було.
Вплив КОРАКСАН на I-калієвий струм фази реполяризації потенціалу дії зазначалося тільки при перевищенні терапевтичної концентрації більш ніж в 30 разів.
Антиішемічний і гемодинамічні ефекти КОРАКСАН
Антиішемічний і антиангінальний ефекти КОРАКСАН (5 мг, 7,5 мг або 10 мг 2 рази на день) з контролю нападів стенокардії, зменшення ішемії міокарда у пацієнтів зі стабільною стенокардією порівняємо з антиангінальними і антиішемічні ефектами атенололу та амлодипіну (100 мг і 10 мг в добу, відповідно). Частота серцевих скорочень і величина подвійного твори (ЧСС х АТ) в спокої і при максимальній фізичному навантаженні як показник споживання кисню міокардом були значно нижче в групі пацієнтів, що одержувала Кораксан, в порівнянні з групою, що одержувала амлодипін.
Частота несприятливих побічних ефектів була порівнянною, Кораксан показав високу переносимість.
Антиангінальний ефект КОРАКСАН зберігається при тривалому регулярному застосуванні без розвитку фармакологічної толерантності. Не виявлено розвитку синдрому відміни після припинення прийому препарату.
Переваги препарату особливо проявляються при необхідності контролю частоти серцевих скорочень пацієнтів, що мають протипоказання до призначення блокаторів бета-блокатори.
Гемодинамический ефект КОРАКСАН визначається збільшенням інтервалу часу між двома потенціалами дії синусового вузла, забезпечуючи зниження частоти серцевих скорочень без системних гемодинамічних ефектів, дозозависимо зменшуючи споживання кисню міокардом, забезпечуючи поліпшення регіонарної скоротливості міокарда в зоні зниженого коронарного кровотоку. На тлі терапії кораксаном не відбувається зміни середнього артеріального тиску, зниження скорочувальної
здатності міокарда, зберігається Ізохоричний тип швидкості розслаблення міокарда лівого шлуночка (що важливо для збереження обсягу лівого шлуночка при серцевій недостатності). У разі дисфункції лівого шлуночка при неадекватній тканинної перфузії в умовах необхідності застосування препаратів позитивного інотропного дії, ці препарати можуть посилити вираженість тахікардії і гіпотонії (добутамін) або, стимулюючи бета-1 адренорецептори, збільшити вивільнення норадреналіну (допаміну), що викличе посилення миокардиальной ішемії. У такій ситуації застосування івабрадину зіграє важливу роль в обмеженні частоти серцевих скорочень без зниження позитивного інотропного ефекту, забезпечуючи поліпшення миокардиального кровотоку при стабілізації гемодинаміки пацієнтів з серцевою недостатністю або в умови кардіогенного шоку. Переваги івабрадину виявляються і при лікуванні пацієнтів з постуральним ортостатическим синдромом, синусовой вузловий re-entry тахікардією, надмірної синусової тахікардією, коли неможливо призначення блокаторів бета-блокатори або блокаторів повільних кальцієвих каналів - препаратів з негативною інотропною і / або гіпотензивним ефектом, які можуть підсилити симптоматику захворювання.
Вплив КОРАКСАН на інтервал QT. Подовження інтервалу QT для препаратів з негативним хронотропного ефектом пов'язано з більш високим ризиком смертності як у пацієнтів із захворюваннями серця, так і в загальній популяції. Подовження інтервалу QT є фактором виникнення потенційно фатальною шлуночкової тахікардії (torsade de pointes) за рахунок зміни процесу реполяризації шлуночків. Дані вивчення впливу івабрадину на показник коригувати (соотнесенного з ЧСС) інтервалу QT (QTc) підтвердили відсутність змін інтервалу QTc на тлі терапії івабрадином.
У пацієнтів зі стабільною стенокардією і нормальними електрофізіологічними параметрами застосування івабрадину не виявило значущого уповільнення проведення імпульсів по передсердях або шлуночках серця. Ці результати демонструють здатність івабрадину зберігати рефрактерний період передсердь, час атріовентрикулярного проведення, тривалість періоду реполяризації.
Не рекомендується одночасне застосування КОРАКСАН з препаратами, які подовжують інтервал QT: хінідином, дізопірамідом, бепреділом, соталолом, ібутилід, аміодароном, пімазідом, зіпразідом, Сертиндол, мефлохіном, галофантрина, пентамідином, цисапридом, еритроміцином.
Спільне застосування з препаратами, які подовжують інтервал QT, може посилити зменшення частоти серцевих скорочень, що вимагає підвищення кардіоконтроля.
Фармакокінетичнівластивості КОРАКСАН
Препарат швидко всмоктується після перорального прийому. Пікова концентрація в плазмі досягається через 1-1,5 год незалежно від дози препарату. Зміна кінетики препарату після прийому їжі не має клінічного значення. Біодоступність препарату після перорального прийому наближається до 40% незалежно від дози препарату.
Середній обсяг розподілу препарату у пацієнтів становить 1,4 л / кг. Зв'язок з білками плазми близько 70%.
Середня концентрація в плазмі при досягненні рівноважного стану становить 10 мг / мл. Рівноважна концентрація препарату досягається протягом 24 год.
Препарат піддається активному метаболізму, ідентифіковано 22 метаболіти.
Основний метаболізм відбувається в печінці за участю цитохрому CYP3A4, поєднане призначення потужних інгібіторів CYP3A4 призводить до підвищення максимальної концентрації і часу напіввиведення препарату, зі збільшенням вираженості зниження частоти серцевих скорочень. Застосування індукторів печінкового метаболізму здатне зменшити площу під фармакокінетичною кривою препарату, не надаючи вплив на електрокардіографічні параметри.
Час напіввиведення КОРАКСАН в умовах регулярного прийому становить близько 2 год. Виводиться у вигляді метаболітів в рівній мірі печінкою і нирками. Менше 10% перорально прийнятої дози виявляється в сечі в незміненому вигляді.
Побічні ефекти
Порушення зорового сприйняття
Найбільш частими побічними ефектами при застосуванні КОРАКСАН є зорові зміни сприйняття (фотопсии), помірно виражені, спонтанно зникаючі в ході терапії.
Фотопсії як проходять зміни яскравості в обмеженій зоні зорового поля вони ініціювалися різкою зміною інтенсивності освітлення, при розгляданні блискучих предметів в яскравому світлі, виникали у 14,5% пацієнтів. Тільки у 1% пацієнтів появу фотопсии стало причиною відмови від лікування або зміни звичайного розпорядку дня.
Механізм виникнення фотопсий - інгібування f-каналів в клітинах сітківки.
Часте побічне явище являє собою розпливчастість зору. Побічні ефекти з боку зору можуть з'явитися обмеженням застосування препарату пацієнтами, які керують різними видами транспортних засобів або работающіі на конвеєрних виробничих лініях.
З боку серцево-судинної системи: часті - брадикардія, AV блокада I ступеня, шлуночкова екстрасистолія; рідкісні - серцебиття, надшлуночкова екстрасистолія.
З боку желучно-кишкового тракту: рідкісні - нудота, запор, діарея.
Загальні порушення: часті - головний біль, запаморочення, рідкісні - задишка, м'язові судоми.
Лабораторні зміни: рідкісні - гіперурикемія, еозинофілія, підвищення рівня креатиніну в плазмі крові.
Показання та протипоказання
Переваги КОРАКСАН при супутніх станах
Стабільна стенокардія + БА / ХОЗЛ
Стабільна стенокардія + сексуальна дисфункція
Стабільна стенокардія + периферичний атеросклероз
Стабільна стенокардія + симптоми слабкості
Стабільна стенокардія + депресія
Стабільна стенокардія + порушення сну
Стабільна стенокардія + відсутність ефекту БАБ
Стабільна стенокардія + помірні порушення A-V проведення
Стабільна стенокардія + СД зі значними коливаннями глікемії
Стабільна стенокардія + нормальний АТ Попередження до призначення КОРАКСАН
Синусовааритмія A-V-блокада II ступеня
Комбінування з іншими препаратами, що знижують ЧСС
артеріальна гіпотонія
Гострий період інсульту ХСН II стадії по NYHA
Помірна печінкова недостатність
Тяжка ниркова недостатність
Пігментна дегенерація сітківки
Протипоказання
Підвищена чутливість до івабрадину чи будь-якого з допоміжних компонентів препарату
ЧСС в спокої менше 60 ударів в хвилину (до початку лікування)
З-А блокада
A-V-блокада III ступеня
Наявність штучного водія ритму
Гострий інфаркт міокарда
кардіогенний шок
нестабільна стенокардія
Виражена артеріальна гіпотонія (АТ нижче 90/50 мм рт.ст.)
ХСН III-IV стадії за NYHA
Важка печінкова недостатність (більше 9 балів за класифікацією Чайлд-П'ю)
Одночасне застосування з сильними інгібіторами цитохрому Р 4503А4 (протигрибкові засоби групи азолів - кетаконазол, интраконазол; макроліди - кларитроміцин, еритроміцин для прийому всередину, джозаміцин, телітроміцин; інгібітори ВІЛ-протеаз - нелфінавір, ритонавір; нефозадон)
Вагітність, годування грудним молоком.
Кораксан зареєстрований Європейським агентством з реєстрації лікарських засобів в липні 2005 р і Фармакологічним комітетом Росії в листопаді 2005 р як симптоматичне лікування стабільної стенокардії у хворих з синусовим ритмом, що мають протипоказання або непереносимість до бета-адреноблокатори.
Сучасними дослідження встановлена \u200b\u200bчітка кореляція серцевого ритму і загальною смертністю - хронічне збільшення ЧСС збільшує ризик розвитку серцево-судинних захворювань, і навпаки, зниження ЧСС, відповідно подовження діастоли, збільшує час перфузії кровоносних судин, знижуючи метаболічні витрати міокарда, покращуючи міокардіальний потік крові. З огляду на важливість даного факту, фахівці продовжують вивчати механізми утворення і контролю серцевого ритму.
Відносно недавно, в 80-х роках минулого століття в клітинах синоатріального вузла був відкритий іонний f-канал, який активується при деполяризації, пізніше він був названий пейсмекерного, оскільки його властивості були підтверджені прямий кореляцією між ступенем його експресії і ЧСС (розвитком брадикардії при його блокаді).
Перший лікарський препарат івабрадін (Кораксан), пов'язаний з блокадою f-каналу, був розроблений в 1999 році.
Механізм дії івабрадину полягає в придушенні I f-каналів синусового вузла, які контролюють спонтанну діастолічну деполяризацію в синусовомувузлі і регулюють ЧСС. Препарат діє селективно, прийом 20 мг івабрадину двічі на день урежаєт ЧСС на 10 ударів / хвилину, в результаті чого знижується робота серця і зменшується потреба міокарда в кисні.
Івабрадін не впливає на внутрішньосерцеву провідність, скоротливість міокарда і процеси реполяризації шлуночків. Після прийому всередину препарат швидко і повністю всмоктується в шлунково-кишковому тракті, максимальна концентрація в крові відзначається через 1,5 години після прийому всередину натщесерце. Біодоступність - 40%. Прийом їжі збільшує час абсорбції препарату на 1 годину, збільшує концентрацію в крові на 10% (до 30%). Зв'язок з білками крові - 70%. Івабрадін метаболізується в печінці та кишечнику. Період напіввиведення препарату - 2 ч. Івабрадін виводиться в основному у вигляді метаболітів і незначної кількості незміненої речовини через нирки і шлунково-кишкового тракту.
Показання до застосування івабрадину:
- лікування стабільної стенокардії у пацієнтів з нормальним синусовим ритмом при непереносимості або протипоказань до застосування бета-блокаторів;
- серцева недостатність.
Протипоказання:
- підвищена чутливість до препарату;
- ЧСС в спокої нижче 60 уд / хв;
- кардіогенний шок;
- гострий ІМ;
- виражена артеріальна гіпотонія (АТ нижче 90/50 мм рт.ст.);
- тяжка печінкова недостатність;
- синдром слабкості синусового вузла;
- синоатріальна блокада, нестабільна стенокардія, АВ-блокада III ступеня;
- одночасне застосування з інгібіторами цитохрому Р4503А4;
- кораксан протипоказаний під час вагітності, в період годування груддю;
- не рекомендований до застосування у віці до 18 років.
- під ча їжі вранці та ввечері по 5 мг;
- доза може бути скоригована через 3-4 тижні (залежно від терапевтичного ефекту) до 15 мг;
- в разі розвитку брадикардії на тлі терапії препаратом (ЧСС менше 50 уд / хв), доза препарату знижується.
Побічна дія:
- порушення зорового сприйняття, пов'язане зі зміною яскравості освітлення (минуще);
- розпливчастість зору;
- брадикардія розвивається у 3,3% хворих в перші 2-3 місяці лікування, у 05% пацієнта розвивається важкий ступінь з ЧСС нижче 40 уд / хв;
- АВ-блокада I ступеня;
- шлуночкова екстрасистолія;
- кораксан не ефективний для лікування і профілактики серцевих аритмій;
- кораксан не рекомендований при фібриляції передсердь (миготливої \u200b\u200bаритмії), іншими типами аритмій, які пов'язані з функцією синусового вузла;
- кораксан не рекомендований спільно з блокаторами повільних кальцієвих каналів, які уповільнюють ЧСС (верапаміл, дилтіазем).
УВАГА! Інформація, представлена \u200b\u200bсайті сайт носить довідковий характер. Адміністрація сайту не несе відповідальності за можливі негативні наслідки в разі прийому будь-яких ліків або процедур без призначення лікаря!
Дисфункція синусового вузла (сидром слабкості синусового вузла)
Синусовий вузол (СУ) в нормі автоматично виробляє електричні імпульси з «внутрішньо властивою частотою». Метод її визначення і формула розрахунку описані в розділі «Спеціальне обстеження хворих з порушеннями ритму серця». Автономна нервова система модулює цю частоту, так що парасимпатичні впливу (ацетилхолін) знижують її, а симпатичні (норадреналін) збільшують. Баланс цих впливів постійно змінюється в залежності від часу доби, положення тіла, рівня фізичної та емоційної навантажень, температури навколишнього середовища, факторів запуску рефлекторних реакцій і т.д. Тому частота синусового ритму протягом доби змінюється в широких межах, знижуючись в стані спокою, особливо уві сні, і більше підвищуються в денний час доби в стані неспання. При цьому поряд з нормосістолія може спостерігатися як синусова тахікардія (ЧСС більше 100 імп / хв) так і синусова брадикардія (ЧСС менше 50 імп / хв). Для характеристики цих станів з точки зору норми і патології (дисфункції синусового вузла) важливо не тільки визначити допустимі межі виразності брадикардії, а й оцінити адекватність наростання частоти синусового ритму у відповідь на пропоновані навантаження.Фізіологічна синусова брадикардія може спостерігатися в денний час доби в стані спокою і в нічний час як переважаючого ритму серця. Вважають, що граничне зниження частоти ритму днем \u200b\u200bв спокої визначається величиною 40 імп / хв, вночі - 35 імп / хв і не залежить від статі і віку. Припускають також розвиток синусових пауз, тривалість яких до 2000 мс не рідкісне явище у здорових осіб. Але їх тривалість не може в нормі перевищувати 3000 мс. Часто у спортсменів високої кваліфікації, а також у осіб важкої фізичної праці, у юнаків реєструють брадикардію з частотою нижче зазначених, можливо в поєднанні з іншими проявами дисфункції синусового вузла. Ці стани можуть бути віднесені до нормальних тільки в тих випадках, коли вони безсимптомні та є адекватний приріст частоти синусового ритму у відповідь на фізичне навантаження.
Оцінка адекватності приросту частоти синусового ритму у відповідь на навантаження часто викликає труднощі в клінічній практиці. Це обумовлено відсутністю універсальних методичних підходів до визначення хронотропной неспроможності і узгоджених критеріїв її діагностики. Найбільшого поширення набуває так званий хронотропний індекс, який обчислюють за результатами проби з фізичним навантаженням по протоколу максимальної по переносимості лімітованої симптомами фізичного навантаження. Хронотропний індекс являє собою відношення (%) різниці між пікової ЧСС на максимумі навантаження і ЧСС спокою (хронотропний відповідь) до різниці між передбаченою за віком максимальної ЧСС, що обчислюється за формулою (220 - вік) (імп / хв) і ЧСС спокою (хронотропний резерв ). Вважають, що в нормі величина хронотропної індексу ≥80%. Пропонуються також уточнені формули, адаптовані до підлоги, наявності серцево-судинних захворювань (ІХС) і прийому бета-блокаторів, але дискусія про доцільність їх клінічного використання триває.
Нормальна функція синусового вузла здійснюється за рахунок спонтанної деполяризації його пейсмекерних N-клітин (автоматизм) і проведення виникають імпульсів транзиторними T-клітинами на міокард передсердь через сино-атріальную (СА) зону (сино-атріального провідність). Порушення будь-якого з цих компонентів призводять до дисфункції синусового вузла (ДСУ). В їх основі лежать численні причини, одні з яких, - внутрішні, призводять до структурних поразок тканини вузла і перінодальной зони (часто поширюючись і на міокард передсердь) або зводяться до первинного порушення функції іонних каналів. Інші, зовнішні причини, обумовлені дією лікарських препаратів, автономними впливами або впливом інших зовнішніх факторів, які призводять до порушення функції СУ при відсутності його органічного ураження. Відносна умовність такого поділу визначається тим, що зовнішні чинники завжди присутні при наявності внутрішніх причин, посилюючи прояви дисфункції синусового вузла.
Найважливішою внутрішньою причиною ДСУ є заміщення тканини синусового вузла фіброзної і жировою тканиною, причому дегенеративний процес зазвичай поширюється на перінодальную зону, міокард передсердь і атріо-вентрікулярний вузол. Це визначає супутні порушення, нерозривно пов'язані з ДСУ. Дегенеративні зміни СУ можуть бути обумовлені ішемією міокарда, включаючи інфаркт міокарда, інфільтративними (саркоїдоз, амілоїдоз, гемохроматоз, пухлини) і інфекційними процесами (дифтерія, хвороба Чагаса, хвороба Лайма), коллагенозами (ревматизм, системний червоний вовчак, ревматоїдний артрит, склеродермія) і іншими формами запалення (міокардит, перикардит). Крім того, є підстави вважати, що поразка артерії синусового вузла різної природи також здатне призводити до порушення функції СУ. Але в більшості випадків має місце ідіопатичний дегенеративний фіброз, нерозривно пов'язаний зі старінням. У молодих частою причиною поразки СУ є травма після перенесеної операції з приводу вроджених вад серця. Описано також сімейні форми дисфункції синусового вузла, при яких відсутні органічні ураження серця, а патологія СУ, що позначається як ізольована, пов'язана з мутаціями в генах, відповідальних за натрієві канали і канали пейсмекерного струму (If) в клітинах СУ.
До числа зовнішніх причин, перш за все, відноситься вплив лікарських препаратів (бета-адреноблокатори, блокатори кальцієвих струмів, серцеві глікозиди, антиаритмічні препарати класу I, III і V, гіпотензивні препарати і ін.). Особливе місце займають опосередковані автономними впливами синдроми, такі як нейро-кардіальні непритомність, гіперчутливість каротидного синуса, рефлекторні впливу, зумовлені кашлем, сечовипусканням, дефекацією і блювотою. До ДСУ призводять порушення електролітного балансу (гіпо- - і гіперкаліємія), гіпотиреоз, рідко гіпертиреоз, гіпотермія, підвищення внутрішньочерепного тиску, гіпоксія (sleep apnea). При ідіопатичних формах ДСУ можливим механізмом служить посилення тонусу вагуса або дефіцит предсердной холінестерази, а також вироблення антитіл до М2-холінорецепторів, що володіють стимулюючою активністю.
Поширеність ДСУ не може бути оцінена адекватно через неможливість обліку безсимптомних випадків і труднощі диференціювання фізіологічної і патологічної брадикардії в популяційних дослідженнях. Частота виявлення ДСУ зростає з віком, але в групі старше 50 років вона становить всього 5/3000 (0,17%). Частота симптоматичних випадків ДСУ оцінюється кількістю імплантацій штучних водіїв ритму (ІВР), але ці цифри сильно варіюють в різних країнах, що пов'язано не тільки з демографічними особливостями і поширеністю захворювання, а й матеріальною забезпеченістю і особливостями показань до імплантації. Проте, на частку ДСУ припадає близько половини всіх імплантацій ЕКС, а частота розподілу їх за віком носить бімодальний характер з піками в інтервалах 20-30 і 60-70 років.
Мал. 1. Електрокардіографічні прояви дисфункції синусового вузла, пов'язані з порушенням функції автоматизму. А - сінусовоя брадикардія. Б - зупинки синусового вузла. В - тривала синусова пауза. Г - посттахікардітіческая зупинка синусового вузла з вислизає ритмом з АВ з'єднання. Д - посттахікардітіческая зупинка синусового вузла з вислизає імпульсами з АВ з'єднання і рецидивом миготливої \u200b\u200bаритмії. Порушення функції СУ мають різноманітні електрокардіографічні прояви. Найбільш частою формою є синусова брадикардія (СБ). Рідкісний передсердний ритм при цьому характеризується порушенням передсердь з області СУ (див. Розділ «Спеціальне обстеження хворих з порушеннями ритму серця»), а при наявності аритмії інтервали R-R змінюються плавно від циклу до циклу (рис. 1А). В основі СБ лежить зниження функції автоматизму СУ.
Більш виражені порушення автоматизму СУ призводять до зупинки СУ, що виявляється синусовой паузою різної тривалості. Характерною особливістю цієї паузи є те, що вона ніколи не кратна тривалості попереднього синусового циклу навіть з урахуванням допуску на аритмію. Існують очевидні складнощі в кваліфікації таких пауз в якості зупинок СУ. Загальноприйнятих кількісних критеріїв на цей рахунок не існує і вирішення питання багато в чому залежить від ступеня вираженості синусової аритмії і середньої частоти попереднього ритму. Незалежно від частоти і вираженості аритмії пауза тривалістю більше подвоєною величини попереднього синусового циклу виразно вказує на зупинку СУ (рис. 1Б). Якщо ж пауза коротше цієї величини, то для констатації зупинки СУ потрібно, виходячи з граничної нормальної частоти 40 імп / хв, щоб вона була більш 2 с, що еквівалентно перевищення попереднього циклу на 25% і більше. Такі паузи, однак, можуть не мати клінічного значення, і тоді критерієм зупинки СУ пропонується тривалість паузи більше 3 с, що виключає фізіологічний її характер.
Іншого роду складності виникають при діагностиці зупинок СУ при дуже тривалих паузах, коли немає повної впевненості в тому, що в основі лежить тільки механізм придушення автоматизму СУ при відсутності одночасної блокади СА проведення (рис. 1В). Використання критерію кратності тут важко застосувати, по-перше, через неоднозначність вибору референтного циклу (рис. 1В), по-друге, через його відсутність у випадках розвитку посттахікардітіческой паузи і, по-третє, через втручання вислизає імпульсів і ритмів (рис. 1Г, Д). Хоча вважають, що в основі посттахікардітіческіх пауз лежить придушення автоматизму СУ частою передсердної импульсацией (overdrive suppression), не виключають також участі порушень СА провідності. Тому при позначенні тривалих Асистолія воліють уникати термінів, вказують на механізм явища, часто застосовуючи термін синусова пауза.
Іншою причиною синусових пауз служить порушення СА проведення. Подовження часу СА проведення (СА блокада I ступеня) не має електрокардіографічних проявів і може бути виявлено тільки прямий реєстрацією потенціалу СУ або непрямими методами з використанням електростимуляції передсердь. При СА блокаді II ступеня Мобитц тип I (з періодикою Венкебаха) відбувається прогресивне збільшення часу проведення послідовних синусових імпульсів по СА зоні доти, поки не розвивається повна блокада чергового імпульсу. На ЕКГ це проявляється циклічними змінами інтервалів P-P з прогресивним їх укороченням, після чого слід пауза, тривалість якої завжди менше подвоєного інтервалу P-P (рис. 2А). При СА блокаді II ступеня Мобитц тип II блокування синусових імпульсів відбувається без попереднього подовження часу СА проведення, і на ЕКГ це проявляється паузами, тривалість яких майже в точності (враховуючи допуск на аритмію) кратна тривалості попереднього інтервалу P-P (рис. 2Б). При подальшому пригніченні СА провідності знижується кратність проведення імпульсів в періодиці аж до розвитку СА блокади II ступеня 2: 1 (рис. 2В). При її стійкому збереженні ЕКГ картина не відрізняється від синусової брадикардії (рис. 2Г). Крім того, блокована передсердна екстрасистолія в формі бигеминии, не маючи відношення до ДСУ, імітує як синусовую брадикардію, так і СА блокаду II ступеня 2: 1 (рис. 2Д). Спотворення хвилі Т, що вказують на можливу присутність передчасного збудження передсердь, не завжди вдається правильно інтерпретувати, оскільки зазубрина на хвилі Т може бути природним проявом порушень реполяризації на тлі рідкісного ритму. Проблему диференціальної діагностики вирішує тривала реєстрація ЕКГ із захопленням перехідних процесів. У випадку з блокованої передсердної екстрасистолією може знадобитися пищеводная електрокардіографія.

Мал. 39. Електрокардіографічні прояви дисфункції синусового вузла, пов'язані з порушенням сино-атриальной провідності. А - СА блокада II ступеня тип I з періодикою 9: 8. Б - СА блокада II ступеня тип II. В - СА блокада II ступеня тип I з періодами 2: 1 і 3: 2. Г - СА блокада II ступеня тип I зі стійким розвитком періодики 2: 1. Д - розвиток епізоду блокованої передсердної екстрасистолії в формі бигеминии, що імітує прояви дисфункції синусового вузла.
Розвиток далекозашедшей СА блокади II ступеня проявляється тривалими синусовим паузами, тривалість яких кратна попереднього предсердному циклу. Але зберігаються ті ж проблеми діагностики механізму тривалої паузи, що описані для зупинки СУ. Одним з провокуючих чинників розвитку далекозашедшей СА блокади II ступеня є критичне почастішання синусовой імпульсації, пов'язане з фізичними або іншими навантаженнями. При цьому різке зниження частоти серцевих скорочень з частоти, яка визначається метаболічними потребами, як правило, проявляється клінічними симптомами.

Мал. 3. Сіно-атріального блокада III ступеня з вислизає ритмами з передсердь. Примітка: зірочками на фрагменті Б вказані синусові імпульси.
Крайній ступінь порушення СА провідності, - СА блокада III ступеня, проявляється відсутністю синусових імпульсів при електричної активності передсердь у вигляді вислизає передсердних ритмів (рис. 3) або ритму з АВ з'єднання. Рідко при цьому можна спостерігати окремі імпульси з СУ (рис. 3Б). Даний стан, важко диференціюється з зупинкою СУ, не слід ототожнювати з повною відсутністю електричної активності передсердь, що позначається як зупинка передсердь (atrial standstill). Це стан пов'язаний з електричною невозбудімості міокарда передсердь при можливо збереженому синусовому механізмі (гіперкаліємія).
Дисфункції СУ часто супроводжує цілий ряд додаткових проявів. Перш за все, це вислизають імпульси і ритми, які виходять із передсердь або АВ з'єднання. Вони виникають при досить тривалих синусових паузах, і від активності їх джерел багато в чому залежить розвиток клінічної симптоматики ДСУ. Як і СУ, водії ритму другого порядку схильні до впливу автономних і гуморальних впливів, а також феномену overdrive suppression. Оскільки при ДСУ від внутрішніх причин характерно поширення дегенеративного процесу на міокард передсердь, це створює основу для розвитку передсердних аритмій, перш за все миготливої \u200b\u200bаритмії. У момент припинення аритмії створюються сприятливі умови для розвитку тривалої асистолії, оскільки автоматизм СУ і водіїв ритму другого порядку знаходяться в пригніченому стані. Це, як правило, призводить до клінічної симптоматиці, і подібний стан у вигляді синдрому тахікардії-брадикардії вперше було описано Д. Шортом в 1954 р Унаслідок поширеного ураження передсердь і важливої \u200b\u200bролі парасимпатичних впливів при ДСУ частим супутнім станом є порушення предсердно-шлуночкової провідності .
Дисфункція СУ і нерозривно пов'язані з нею клінічні прояви і супутні аритмії формують клініко-електрокардіографічних симптомокомплекс. Вперше Б.Лаун, спостерігаючи різні прояви ДСУ після електричної кардіоверсії миготливої \u200b\u200bаритмії з характерною низькою частотою шлуночкових скорочень, застосував термін sick sinus syndrome, перекладений на російську мову і укорінений як синдром слабкості синусового вузла (Протипоказання). Надалі під цим терміном були об'єднані як самі прояви ДСУ, так і супутні аритмії, включаючи синдром тахікардії-брадикардії, і супутні порушення предсердно-желудочкового проведення. Пізніше була додана хронотропні неспроможність. Відбувалася еволюція термінології призвела до того, що в даний час кращим терміном для позначення даного синдрому є дисфункція синусового вузла, а термін Протипоказання пропонують використовувати у випадках ДСУ з клінічною симптоматикою. Даний синдром включає в себе:
- персистирующую, частіше виражену, синусовую брадикардію;
- зупинки синусового вузла і сино-атріального блокади;
- персистирующую фибрилляцию і тріпотіння передсердь з низькою частотою шлуночкових скорочень при відсутності медикаментозної урежающей терапії;
- хронотропну неспроможність.
В діагностиці ДСУ найважливішим завданням є підтвердження зв'язку клінічної симптоматики з брадикардією, тобто виявлення клініко-електрокардіографічної кореляції. Саме тому найважливішими елементами обстеження хворого стають ретельний аналіз скарг хворого, детально описаний в розділі «Диференціальна діагностика непритомності», і електрокардіографічне обстеження. Оскільки стандартна ЕКГ в рідкісних випадках може бути зареєстрована в момент розвитку симптомів, які носять тимчасовий характер, основну роль грають методи тривалого ЕКГ моніторування. До них відносяться холтерівське моніторування ЕКГ, використання реєстраторів подій з петлевою пам'яттю, віддалене (домашнє) моніторування ЕКГ і імплантація ЕКГ реєстраторів. Показання до їх використання див. В розділі «Спеціальне обстеження хворих з порушеннями ритму серця». Одержані за допомогою цих методів результати безпосередньо орієнтують щодо напрямків лікування. Використання одного тільки холтерівського моніторування тривалістю до 7 діб дозволяє встановити клініко-електрокардіолографіческую кореляцію не менше, ніж в 48% випадків. Однак в ряді випадків дана стратегія діагностики дає занадто відстрочений результат, що може бути неприйнятним у зв'язку з важкістю клінічної симптоматики. У цих випадках застосовують провокують тести, які, на жаль, характеризуються досить високою частотою помилково-позитивних і хибно-негативних результатів.
В якості таких методів (див. Розділ «Спеціальне обстеження хворих з порушеннями ритму серця») проба з фізичним навантаженням надає неоціненну допомогу в діагностиці хронотропной неспроможності і у виявленні ДСУ, пов'язаної в природних умовах з фізичним навантаженням. Як провокують нейро-рефлекторних тестів важливу роль відіграють масаж каротидного синуса і пасивна ортостатична проба. Для оцінки ролі зовнішніх і внутрішніх причин ДСУ (Протипоказання) мають значення фармакологічні тести. Електростимуляція передсердь для діагностики ДСУ обмежена в своєму застосуванні, що пов'язано з низькою частотою виявлення позитивної клініко-електрокардіографічної кореляції, а показанням до інвазивного ЕФД служить необхідність виключення інших аритмических причин синкопальних станів.
Лікування хворих з ДСУ передбачає наступні напрямки: усунення брадикардії з її клінічними проявами, усунення супутніх порушень ритму серця і попередження тромбоемболічних ускладнень і, зрозуміло, лікування основного захворювання. Безсимптомні хворі з ДСУ при відсутності органічних захворювань серця і супутніх аритмій лікування не вимагають. У той же час такі пацієнти повинні уникати лікарських препаратів, які можуть бути призначені за причинами, не пов'язаними з серцево-судинною патологією і які пригнічують функцію СУ (препарати літію та інші психотропні засоби, циметидин, аденозин і ін.). При наявності органічних серцево-судинних захворювань ситуація ускладнюється необхідністю призначення таких препаратів (бета-адреноблокатори, блокатори кальцієвих каналів, серцеві глікозиди). Особливі проблеми можуть виникнути в зв'язку з призначенням антиаритмічних препаратів для лікування супутніх аритмій, перш за все, фібриляції передсердь. Якщо при цьому не вдається домогтися бажаного результату вибором лікарських препаратів, в меншій мірі впливають на функцію СУ, або зменшенням дози препаратів, то збільшення ДСУ з появою її клінічних симптомів потребують імплантації ІВР. У пацієнтів з уже наявною клінічною симптоматикою ДСУ питання про імплантацію ИВР вимагає першочергового розгляду.
Постійна електростимуляція серця усуває клінічні прояви ДСУ, але не впливає на загальну смертність. При цьому виявляється, що однокамерна передсердна стимуляція (AAIR) або двокамерна стимуляція (DDDR) мають переваги перед однокамерною стимуляцією шлуночків (VVIR): підвищується толерантність до фізичного навантаження, знижується частота пейсмекерного синдрому і, що особливо важливо, знижується частота розвитку фібриляції передсердь і тромбоемболічних ускладнень. Більш того, виявлені переваги двухкамерной стимуляції перед однокамерною предсердной стимуляцією, які визначаються меншою частотою розвитку пароксизмів фібриляції передсердь і меншою частотою реімплантацію стимуляторів, які потрібні при передсердній стимуляції в зв'язку з розвитком порушень передсердно-шлуночкової провідності. Показано також, що тривала стимуляція правого шлуночка через діссінхроніі збудження викликає порушення скорочувальної функції лівого шлуночка, і для зменшення числа нав'язаних шлуночкових порушень при двокамерному стимуляції застосовуються алгоритми, що дають перевагу власним проведеним на шлуночки імпульсам. Таким чином, в даний час методів стимуляції першого вибору визнається двухкамерная стимуляція серця з частотної адаптацією і управлінням АВ затримкою (DDDR + AVM). Показання до цього методу лікування представлені в табл. 1.Слід, однак, враховувати, що в разі розвитку ДСУ в зв'язку з минущими явно оборотними причинами питання про імплантацію кардіостимулятора повинен бути відкладений, а лікування спрямоване на корекцію викликали станів (передозування лікарських препаратів, електролітні порушення, наслідки інфекційних захворювань, дисфункція щитовидної залози і т . Д.). Як засоби усунення ДСУ можуть бути використані препарати атропіну, теофіліну, тимчасова електростимуляція серця. Персистирующую фибрилляцию передсердь з низькою частотою шлуночкових скорочень слід розглядати як природне самоизлечение від ДСУ і утримуватися від відновлення синусового ритму.
Антитромботична терапія повинна проводитися у всіх випадках супутніх передсердних тахіаритмій в повній відповідності з рекомендаціями по антитромботичної терапії фібриляції передсердь (див. Відповідний розділ Керівництва).З урахуванням сучасного лікування прогноз ДСУ визначається основним захворюванням, віком, наявністю серцевої недостатності і тромбоемболічних ускладненнями, на частоту яких може впливати адекватна антитромботична терапія і адекватний вибір режиму електрокардіостимуляції.
Таблиця 1.Показання до постійної стимуляції серця при дисфункції синусового вузла

Показання до застосування
Терапія стабільної стенокардії у пацієнтів з нормальним синусовим ритмом:
При непереносимості або наявності протипоказань до застосування бета-блокаторів.
У комбінації з бета-адреноблокаторами при неадекватному контролі стабільної стенокардії на тлі оптимальної дози бета-адреноблокатора.
Хронічна серцева недостатність:
Для зниження частоти розвитку серцево-судинних ускладнень у пацієнтів з хронічною серцевою недостатністю, з синусовим ритмом і ЧСС не менше 70 уд / хв.
Опис впливу на організм
Івабрадін - препарат, що уповільнює ритм серця, механізм дії якого полягає в селективному і специфічному інгібуванні If каналів синусового вузла, контролюючих спонтанну діастолічну деполяризацію в синусовомувузлі і регулюючих ЧСС. Івабрадін надає селективне вплив на синусовий вузол, не впливаючи на час проведення імпульсів по внутрішньопередсердну, предсердно-шлуночкових і внутрішньошлуночкових провідних шляхах, а також скоротливу здатність міокарда і реполяризацию шлуночків. Івабрадін також може взаємодіяти з Ih
каналами сітківки ока, схожими з If каналами серця, які беруть участь у виникненні тимчасової зміни системи зорового сприйняття за рахунок зміни реакції сітківки на яскраві світлові стимули. При провокують обставин часткове інгібування Ih каналів івабрадином викликає феномен зміни світосприйняття .
Для фотопсии характерно минуще зміна яскравості в обмеженій області зорового поля. Основною фармакологічною особливістю івабрадину є його здатність дозозависимого зниження ЧСС.
Аналіз залежності величини зниження ЧСС від дози препарату проводився при поступовому збільшенні дози івабрадину до 20 мг 2 рази / добу і виявив тенденцію до досягнення ефекту плато, що знижує ризик розвитку вираженої брадикардії. При призначенні препарату в рекомендованих дозах ступінь уражень ЧСС залежить від її початкової величини і становить приблизно 10-15 уд. / Хв в спокої і при фізичному навантаженні.
В результаті знижується робота серця і зменшується потреба міокарда в кисні.
Івабрадін не впливає на внутрішньосерцеву провідність, скоротливість міокарда або процес реполяризації шлуночків серця.
У клінічних електрофізіологічних дослідженнях івабрадін не впливав на час проведення імпульсів по передсердно-шлуночкових або внутрішньошлуночкових провідних шляхах, а також на скориговані інтервали QT.
У дослідженнях за участю пацієнтів з дисфункцією лівого шлуночка 30-45%) було показано, що івабрадін не впливає на скоротливу здатність міокарда. Встановлено, що івабрадін в дозі 5 мг 2 рази / добу поліпшував показники навантажувальних проб вже через 3-4 тижні терапії.
Ефективність була підтверджена і для дози 7,5 мг 2 рази / добу.
Зокрема, додатковий ефект при збільшенні дози з 5 мг до 7,5 мг 2 рази / добу був встановлений в порівняльному дослідженні з атенололом.
Час виконання фізичного навантаження збільшилася приблизно на 1 хв вже через 1 місяць застосування івабрадину у дозі 5 мг 2 рази / добу, при цьому після додаткового 3-місячного курсу прийому івабрадину у дозі 7,5 мг 2 рази / добу всередину відзначений подальший приріст цього показника на 25 сек.
Антиангінальну і антиішемічна ефективність івабрадину підтверджувалася і для пацієнтів у віці 65 років і старше.
Ефективність івабрадину при застосуванні в дозах 5 мг і 7,5 мг 2 рази / добу відзначалася в зазначених дослідженнях щодо всіх показників навантажувальних проб, а також супроводжувалася зменшенням частоти розвитку нападів стенокардії приблизно на 70%.
Застосування івабрадину 2 рази / добу забезпечувало постійну терапевтичну ефективність протягом 24 год. У пацієнтів, які приймали івабрадін, показана додаткова ефективність івабрадину у відношенні всіх показників навантажувальних проб при додаванні до максимальної дозі атенололу на спаді терапевтичної активності. Чи не показано поліпшення показників ефективності івабрадину при додаванні до максимальної дозі амлодипіну на спаді терапевтичної активності, в той час як на максимумі активності додаткова ефективність івабрадину була доведена. У дослідженнях клінічної ефективності препарату ефективність івабрадину повністю зберігалися протягом 3-х і 4-х місячних періодів лікування.
Під час лікування ознаки розвитку толерантності були відсутні, а після припинення лікування синдрому "відміни" не відзначалося.
Антиангінальні та антиішемічні ефекти івабрадину були пов'язані з дозозалежним уражень ЧСС, а також зі значним зменшенням робочого твори, причому як в спокої, так і при фізичному навантаженні.
Вплив на показники артеріального тиску і ОПСС було незначним і клінічно незначущим.
Сталий зменшення частоти серцевих скорочень було продемонстровано у пацієнтів, що приймають івабрадін як мінімум протягом 1 року.
Впливу на вуглеводний обмін і ліпідний профіль при цьому не спостерігалося. У пацієнтів з цукровим діабетом показники ефективності і безпечності застосування івабрадину були схожими з такими в загальній популяції пацієнтів.
Не виявлено відмінностей між групами пацієнтів, що приймали івабрадін на тлі стандартної терапії, і у пацієнтів зі стабільною стенокардією і дисфункцією лівого шлуночка, 86.9% яких отримували бета-адреноблокатори, і плацебо, за сумарною частоті летальних випадків від серцево-судинних захворювань, госпіталізації з приводу гострого інфаркту міокарда, госпіталізації з приводу виникнення нових випадків серцевої недостатності або посилення симптомів перебігу хронічної серцевої недостатності і в підгрупі пацієнтів з ЧСС не менше 70 уд. / хв. На тлі застосування івабрадину у пацієнтів з ЧСС не менше 70 уд. / Хв показано зниження частоти госпіталізацій з приводу фатального і нефатального інфаркту міокарда на 36% і частоти реваскуляризації на 30%. У пацієнтів зі стенокардією напруги на тлі прийому івабрадину відзначено зниження відносного ризику настання ускладнень на 24%.
Зазначене терапевтичне перевагу досягається, насамперед, за рахунок зниження частоти госпіталізації з приводу гострого інфаркту міокарда на 42%. Зниження частоти госпіталізації з приводу фатального і нефатального інфаркту міокарда у пацієнтів з ЧСС більше 70 уд. / Хв.
ще більш значуще і досягає 73%.
В цілому відзначена добра переносимість та безпечність препарату. На тлі застосування івабрадину у пацієнтів з ХСН II-IV функціонального класу за класифікацією NYHA з ФВЛШ менше 35% показано клінічно і статистично значуще зниження відносного ризику настання ускладнень на 18%.
Абсолютне зниження ризику склало 4.2%.
Виражений терапевтичний ефект спостерігався через 3 місяці від початку терапії. Зниження смертності від серцево-судинних захворювань і зниження частоти госпіталізацій у зв'язку з посиленням симптомів перебігу ХСН спостерігалося незалежно від віку, статі, функціонального класу ХСН, застосування бета-блокаторів, ішемічної або неішемічної етіології ХСН, наявності цукрового діабету або артеріальної гіпертензії в анамнезі. Пацієнти з симптомами ХСН з синусовим ритмом і з ЧСС не менше 70 уд. / Хв отримували стандартну терапію, що включає застосування бета-блокаторів, інгібіторів АПФ і / або антагоністів рецепторів ангіотензину II, діуретиків і антагоністів альдостерону. Показано, що застосування івабрадину протягом 1 року може запобігти один летальний результат або одну госпіталізацію у зв'язку з серцево-судинним захворюванням на кожні 26 пацієнтів, що приймають препаратний тлі застосування івабрадину показано поліпшення функціонального класу ХСН за класифікацією NYHA. У пацієнтів з ЧСС 80 уд. / Хв відзначено зниження ЧСС в середньому на 15 уд. / Хв.
Протипоказання до препарату
.
.
.
.
.
.
.
.
.
.
Одночасне застосування з сильними інгібіторами ізоферменту цитохрому P450 3А4, такими як протигрибкові засоби групи азолів, антибіотиками з групи макролідів, інгібіторами ВІЛ-протеази і нефазодон.
Дефіцит лактази, непереносимість лактози, синдром мальабсорбції глюкози-галактози.
.
.
.
Підвищена чутливість до івабрадину чи будь-якого компонента препарату.
З обережністю слід призначати препарат при помірній печінковій недостатності, тяжкій нирковій недостатності, природженому подовженні інтервалу QT, одночасному прийомі лікарських засобів, які подовжують інтервал QT, одночасному прийомі помірних інгібіторів ізоферменту CYP 3A4 і грейпфрутового соку, безсимптомною дисфункції лівого шлуночка, AV-блокаді II ступеня, недавно перенесеному інсульті, пігментної дегенерації сітківки, гіпотензії, одночасному застосуванні з блокаторами "повільних" кальцієвих каналів, урежаться ЧСС, такими як верапаміл або дилтіазем.
Побічні дії на організм
Застосування препарату вивчалося в дослідженнях за участю майже 14 000 пацієнтів. Найбільш часто побічні ефекти івабрадину носили дозозалежний характер і були пов'язані з механізмом дії препарату.
Частота побічних реакцій, які були відзначені в клінічних дослідженнях, наведена у вигляді такої градації: дуже часто; часто; не часто; рідко; дуже рідко; неуточненої частоти.
З боку органу зору:
Дуже часто - зміни світосприйняття.
Наступні небажані явища, виявлені в клінічних дослідженнях, виникали з однаковою частотою як в групі пацієнтів, які отримували івабрадін, так і в групі порівняння, що передбачає їх зв'язок із захворюванням як таким, а не з прийомом івабрадину: синусовааритмія, стенокардія, в т. ч. нестабільна, миготлива аритмія, ішемія міокарда, інфаркт міокарда і шлуночковатахікардія.
Застереження до використання
При вагітності:
Кораксан ® протипоказаний до застосування при вагітності. На даний момент є недостатня кількість даних про застосування препарату при вагітності.
У доклінічних дослідженнях івабрадину виявлено ембріотоксичну і тератогенну дію.
Застосування препарату Кораксан ® в період годування груддю протипоказано. Відсутні відомості про проникнення івабрадину в грудне молоко.
Порушення серцевого ритму:
Кораксан ® неефективний для лікування або профілактики аритмій. Його ефективність знижується на тлі розвитку тахіаритмії. Препарат не рекомендується пацієнтам з фібриляцією передсердь або іншими типами аритмій, пов'язаними з функцією синусового вузла.
Під час терапії слід проводити клінічне спостереження за пацієнтами на предмет виявлення фібриляції передсердь. При клінічних показаннях в поточний контроль слід включати ЕКГ.
Застосування у пацієнтів з брадикардією:
Кораксан ® протипоказаний, якщо до початку терапії ЧСС в спокої становить менше 60 уд. / Хв. Якщо на тлі терапії ЧСС в спокої урежается до значень менше 50 уд. / Хв, або у хворого виникають симптоми, пов'язані з брадикардією, необхідно зменшити дозу препарату. Якщо при зниженні дози препарату ЧСС залишається менше 50 уд. / Хв, або зберігаються симптоми, пов'язані з брадикардією, то прийом препарату Кораксан ® слід припинити.
Комбіноване застосування в складі антиангінальної терапії:
Застосування препарату Кораксан ® спільно з блокаторами "повільних" кальцієвих каналів, що знижують ЧСС, такими як верапаміл або дилтіазем, не рекомендоване.
При комбінованому застосуванні івабрадину з нітратами і блокаторами "повільних" кальцієвих каналів - похідними дигідропіридинового ряду, такими як амлодипін, зміни профілю безпеки проведеної терапії відзначено не було. Не встановлено, що комбіноване застосування з блокаторами "повільних" кальцієвих каналів підвищує ефективність івабрадину.
Функції зорового сприйняття:
Кораксан ® впливає на функцію сітківки ока. В даний час не було виявлено токсичного впливу івабрадину на сітківку ока, однак вплив препарату на сітківку ока при тривалому застосуванні на сьогоднішній день невідомо. При виникненні порушень зорових функцій, що не описаних в цьому посібнику, необхідно розглянути питання про припинення прийому препарату Кораксан ®. Пацієнтам з пігментного дегенерацією сітківки препарат Кораксан ® слід приймати з обережністю.
Допоміжні речовини:
До складу препарату входить лактоза, тому Кораксан ® не рекомендується пацієнтам з дефіцитом лактази, непереносимістю лактози, синдромом мальабсорбції глюкози-галактози.
Артеріальна гіпотензія:
Через недостатню кількість клінічних даних препарат слід призначати з обережністю пацієнтам з артеріальною гіпотензією.
Кораксан ® протипоказаний при вираженій артеріальній гіпотензії.
Фібриляція передсердь - серцеві аритмії:
Чи не доведено збільшення ризику розвитку вираженої брадикардії на тлі прийому препарату Кораксан ® при відновленні синусового ритму під час фармакологічної кардіоверсії. Проте, через відсутність достатньої кількості даних, при можливості відстрочити електричну кардіоверсію, прийом препарату Кораксан ® слід припинити за 24 годин до її проведення.
Застосування у пацієнтів з вродженим синдромом подовженого інтервалу QT або хворих, які приймають препарати, що подовжують інтервал QT:
Кораксан ® не слід призначати при вродженому синдромі подовженого інтервалу QT, a також в комбінації з препаратами, які подовжують інтервал QT. При необхідності такої терапії необхідний суворий контроль ЕКГ.
Помірна печінкова недостатність:
При помірній печінковій недостатності терапію препаратом Кораксан ® слід проводити з обережністю.
Тяжка ниркова недостатність:
При тяжкій нирковій недостатності терапію препаратом Кораксан ® слід проводити з обережністю.
Вплив на здатність керувати транспортними засобами та механізмами:
Застосування препарату Кораксан ® не погіршує якість управління автотранспортом. Кораксан ® не впливає на здатність керувати автотранспортом і виконувати роботи, що вимагають високої швидкості психомоторних реакцій. Однак слід пам'ятати про можливість появи фотопсии при різкій зміні інтенсивності освітлення, особливо при керуванні автотранспортом в нічний час.
як застосовувати
Кораксан ® слід приймати всередину 2 рази / добу, вранці та ввечері під час прийому їжі.
При стабільній стенокардії початкова доза препарату становить 10 мг / сут. Залежно від терапевтичного ефекту, через 3-4 тижні застосування доза препарату може бути збільшена до 15 мг. Якщо на тлі терапії препаратом Кораксан ® ЧСС в спокої урежается до значень менше 50 уд. / Хв, або у хворого виникають симптоми, пов'язані з брадикардією, необхідно зменшити дозу препарату Кораксан ® 2 рази / добу). Якщо при зниженні дози препарату Кораксан ® ЧСС залишається менше 50 уд. / Хв або зберігаються симптоми вираженої брадикардії, прийом препарату слід припинити .:
У разі, якщо ЧСС стабільно не більше 50 уд. / Хв або в разі прояву симптомів брадикардії, таких як запаморочення, підвищена стомлюваність або артеріальна гіпотензія доза може бути зменшена до 2,5 мг 2 рази / добу.
Якщо значення ЧСС знаходиться в діапазоні від 50 до 60 уд. / Хв, рекомендується застосовувати препарат Кораксан ® в дозі 5 мг 2 рази / добу.
Якщо в процесі застосування препарату ЧСС в стані спокою стабільно менше 50 уд. / Хв або якщо у пацієнта відзначаються симптоми брадикардії, для пацієнтів, які отримують препарат Кораксан ® в дозі 5 мг 2 рази / добу або 7,5 мг 2 рази / добу, доза препарату повинна бути знижена.
Якщо у пацієнтів, які отримують препарат Кораксан ® в дозі 2.5 мг 2 рази / добу або 5 мг 2 рази / добу, ЧСС в стані спокою стабільно більше 60 уд. / Хв, доза препарату може бути збільшена.
Якщо ЧСС не більше 50 уд. / Хв або у пацієнта зберігаються симптоми брадикардії, застосування препарату слід припинити.
У пацієнтів у віці 75 років і старше рекомендована початкова доза препарату Кораксан ® становить 2,5 мг (по 1/2 таб. 5 мг) 2 рази / добу. Надалі можливе збільшення дози препарату.
пацієнтам з порушенням функції нирок при КК понад 15 мл / хв рекомендована початкова доза препарату Кораксан ® становить 10 мг / добу (по 1 таб. 5 мг 2 рази / добу). Залежно від терапевтичного ефекту, через 3-4 тижні застосування доза препарату може бути збільшена до 15 мг (по 1 таб. 7.5 мг 2 рази / добу).
Через нестачу клінічних даних щодо застосування препарату Кораксан ® у пацієнтів з КК менше 15 мл / хв, Препарат слід застосовувати з обережністю.
Пацієнтам з легким ступенем печінкової недостатності (до 7 балів за шкалою Чайлд-П'ю) рекомендується звичайний режим дозування. Рекомендована початкова доза препарату Кораксан ® становить 10 мг / добу (по 1 таб. 5 мг 2 рази / добу). Залежно від терапевтичного ефекту через 3-4 тижні застосування доза препарату може бути збільшена до 15 мг (по 1 таб. 7.5 мг 2 рази / добу).
Слід дотримуватися обережності при застосуванні препарату у пацієнтів з помірною печінковою недостатністю (7-9 балів за шкалою Чайлд- П'ю).
Кораксан ® протипоказаний пацієнтам з ступенем порушень функції печінки (більше 9 балів за шкалою Чайлд-П'ю), Оскільки застосування препарату у таких пацієнтів не вивчалося (можна очікувати істотного збільшення концентрації препарату в плазмі крові).
Наслідки неправильного дозування
симптоми:
Виражена і тривала брадикардія.
лікування:
Вираженої брадикардії повинно бути симптоматичним і проводитися в спеціалізованих відділеннях. У разі розвитку брадикардії в поєднанні з порушеннями показників гемодинаміки показано симптоматичне лікування з в / в введенням бета-адреноміметиків, таких як ізопреналін. При необхідності можлива постановка штучного водія ритму.
Поєднання з іншими ліками
Слід уникати одночасного застосування івабрадину та лікарських засобів, які подовжують інтервал QT оскільки зменшення частоти серцевих скорочень може викликати додаткове подовження інтервалу QT. При необхідності спільного призначення цих препаратів слід ретельно контролювати показники ЕКГ .:
Івабрадін метаболізується в печінці за участю ферментів системи цитохрому Р450 і є дуже слабким інгібітором даного ізоферменту. Івабрадін не робить істотного впливу на метаболізм і концентрацію в плазмі крові інших субстратів цитохрому CYP3A4. У той же час, інгібітори та індуктори ізоферменту CYP3A4 можуть вступати у взаємодію з івабрадином і надавати клінічно значущий вплив на його метаболізм і фармакокінетичнівластивості. Було встановлено, що інгібітори ізоферменту CYP3A4 підвищують, а індуктори ізоферменту CYP3A4 зменшують плазмові концентрації івабрадину .:
Підвищення концентрації івабрадину в плазмі крові може збільшувати ризик розвитку вираженої брадикардії.
Протипоказані поєднання лікарських засобів:
Одночасне застосування івабрадину з потужними інгібіторами ізоферменту CYP3A4, такими як протигрибкові засоби групи азолів, антибіотики групи макролідів, інгібітори ВІЛ-протеази і нефазодон протипоказано. Потужні інгібітори ізоферменту CYP3A4 - кетоконазол або джозамицин підвищують середні концентрації івабрадину в плазмі крові в 7-8 разів.
Небажані поєднання лікарських засобів:
Спільне застосування івабрадину та помірних інгібіторів ізоферменту CYP3A4 дилтиазема або верапамілу у здорових добровольців і пацієнтів супроводжувалося збільшенням AUC івабрадину в 2-3 рази і додатковим уражень ЧСС на 5 уд. / Хв. Дане застосування не рекомендується .:
Поєднання лікарських засобів, що вимагають обережності:
Індуктори ізоферменту CYP3A4, такі як рифампіцин, барбітурати, фенітоїн і рослинні засоби, що містять звіробій продірявлений, при спільному застосуванні можуть привести до зниження концентрації в крові і активності івабрадину та вимагати підбору більш високої дози івабрадину. При спільному застосуванні івабрадину та препаратів, що містять звіробій продірявлений, було відзначено дворазове зниження AUC івабрадину. У період терапії препаратом Кораксан ® слід по можливості уникати застосування препаратів і продуктів, що містять звіробій продірявлений .:
Комбіноване застосування з іншими лікарськими засобами:
Показано відсутність клінічно значущого впливу на фармакодинаміку і фармакокінетику івабрадину при одночасному застосуванні таких лікарських засобів: інгібіторів протонної помпи, інгібіторів ФДЕ5, інгібіторів ГМГ-КоА-редуктази, блокаторів повільних кальцієвих каналів - похідних дигідропіридинового ряду, дигоксину і варфарину. Показано, що івабрадін не робить клінічно значущого впливу на фармакокінетику симвастатину, амлодипіну, лацидипіну, фармакокінетику і фармакодинаміку дигоксину, варфарину і на фармакодинаміку ацетилсаліцилової кислоти.
Івабрадін застосовувався в комбінації з інгібіторами АПФ, антагоністами рецепторів ангіотензину II, бета-адреноблокаторами, діуретиками, антагоністами альдостерону, нітратами короткої та пролонгованої дії, інгібіторами ГМГ-КоА-редуктази, фібратами, інгібіторами протонної помпи, пероральними гіпоглікемічними засобами, ацетилсаліциловою кислотою та іншими антиагрегантними засобами. Застосування перерахованих вище лікарських засобів не супроводжувалося зміною профілю безпеки проведеної терапії.
Інші види взаємодії, що вимагають обережності при спільному застосуванні:
На тлі прийому грейпфрутового соку відзначалося підвищення концентрації івабрадину в крові в 2 рази. У період терапії препаратом Кораксан ® по можливості слід уникати вживання грейпфрутового соку .:
Значна зв'язок між рівнем частоти серцевих скорочень (ЧСС) у спокої, з одного боку, і загальної та серцево-судинної смертністю, з іншого боку, відзначена в численних епідеміологічних дослідженнях, що проводилися за останні 25 років. Цей зв'язок продемонстрована як для загальної популяції, так і для хворих з різними серцево-судинними порушеннями: на артеріальну гіпертензію, гострий інфаркт міокарда, хронічну ішемічну хворобу серця (ІХС), хронічну серцеву недостатність (ХСН), безсимптомною систолічною дисфункцією лівого шлуночка (ЛШ). Два недавно оприлюднених великих дослідження з особливо тривалим періодом спостереження істотно розширили наші уявлення про прогностичної значимості ЧСС. У першому з них (X. Jouven et al., 2005) ЧСС в спокої і при навантаженні оцінювалася у 15 713 чоловіків у віці 42-53 років (без серцево-судинних захворювань), за якими потім спостерігали в середньому протягом 23 років. Відзначено, що загальна смертність, частота смерті від інфаркту міокарда, а також частота раптової смерті прогресивно збільшувалися зі зростанням ЧСС в спокої (в групах з вихідної ЧСС в межах< 60, 60-64, 65-69, 70-75 и > 75 уд. в хвилину), причому цей ефект не залежав від віку, наявності цукрового діабету, рівня артеріального тиску, маси тіла, рівня фізичної активності та інших факторів.
Друге дослідження (A. Diaz et al., 2005) включало 24 913 чоловіків і жінок з передбачуваним або встановленим діагнозом ІХС, середній період спостереження за ними склав 14,7 року. Показана прямий зв'язок між загальною і серцево-судинної смертністю, з одного боку, і рівнем ЧСС в спокої при початку дослідження, з іншого боку. Цей зв'язок не залежала від наявності артеріальної гіпертензії, цукрового діабету, куріння, рівня фракції викиду ЛШ; вона була значущою для осіб обох статей, в більш і менш старших вікових групах (≤ 65 і\u003e 65 років), при різних рівнях індексу маси тіла (≤ 27 і\u003e 27 кг / м 2).
З урахуванням цих та подібних їм даних в даний час підвищена частота серцевих скорочень розглядається в якості незалежного серцево-судинного фактора ризику. Так, тахікардія вперше в 2007 р включена в число серцево-судинних факторів ризику в Рекомендації по АГ Європейського товариства кардіологів. Рекомендаціями експертів США з лікування хворих зі стабільною стенокардією (2007) підвищена частота серцевих скорочень також визнана фактором серцево-судинного ризику; для цих пацієнтів встановлено цільові значення ЧСС (target heart rate) в межах< 60 уд. в минуту.
Несприятливі ефекти підвищеної ЧСС, з якими пов'язують її несприятливий вплив на ступінь серцево-судинного ризику (адаптовано з A. Hjalmarson, 2007; K. Foxet al., 2007):
Артерії, атеросклероз:
- збільшення ригідності стінки артерій, зменшення їх податливості і розтяжності;
- збільшення shear stress, збільшення механічного навантаження на судинний ендотелій;
- збільшення темпу прогресії атеросклеротичної бляшки;
- збільшення ризику розриву атеросклеротичної бляшки.
Ішемія міокарда:
- збільшення споживання кисню міокардом;
- збільшення тривалості діастоли, зменшення часу діастолічної перфузії, збільшення співвідношення між тривалістю систоли і діастоли;
- несприятливий перерозподіл коронарного кровотоку з його зниженням особливо в субендокарде;
- несприятлива зміна фазового складу діастоли (в меншій мірі, ніж інші фази, коротшає фаза изоволюмического розслаблення ЛШ, при цьому відносно довше триває період екстравазальної компресії малих коронарних артерій).
Шлуночкові аритмії:
- збільшення ризику розвитку життєво небезпечних шлуночкових аритмій, особливо пов'язаних з ішемією міокарда.
прогноз:
- збільшення ризику розвитку інфаркту міокарда, раптової смерті, серцево-судинної і загальної смертності.
Загальна характеристика івабрадину
Івабрадін - єдиний дозволений до клінічного застосування представник нового фармакологічного класу - блокаторів I f-каналів пейсмейкерних клітин синусового вузла. Його дія щодо цих каналів селективно і специфічно, оскільки він взаємодіє тільки з ними, не впливаючи на інші іонні канали мембрани клітин. Завдяки впливу на I f-канали синусового вузла івабрадін зменшує ЧСС при синусовому ритмі в спокої і при навантаженні; внаслідок селективного характеру цього впливу він не впливає на симпатичну систему, не викликає вазодилатації і гіпотензії, не впливає на скоротність міокарда і провідність. Івабрадін не збільшує ризик розвитку епізодів фібриляції передсердь, не збільшує частоту наджелудочковой і шлуночкової екстрасистолії. Стандартна початкова доза - по 5 мг 2 рази на добу, в подальшому можливий переклад на прийом в дозі по 7,5 мг 2 рази на добу. Дія івабрадину на ЧСС тривалий і стійкий - при використанні препарату протягом багатьох місяців ослаблення цього ефекту не відбувається.
Івабрадін добре переноситься і при адекватному призначення рідко викликає значиму (< 40 уд. в минуту) брадикардию. С учетом того, что ивабрадин, влияя на I f (HCN4)-каналы синусового узла, в части случаев может также слабо взаимодействовать с HCN1- и HCN2-каналами, расположенными в структурах сетчатки, у небольшого числа больных (3-5 %) могут отмечаться так называемые визуальные симптомы, которые характеризуются появлением светлых пятен в поле зрения умеренной или средней интенсивности (их возникновение провоцирует внезапное изменение освещенности). Этот эффект дозозависим; если возникает, то в первые 2 месяца лечения; по характеру — транзиторен и обычно полностью исчезает без прекращения лечения (лишь в 1 % случаев требуется отмена препарата). Для ивабрадина отсутствуют синдромы отмены, рикошета и толерантности. Препарат хорошо комбинируется практически со всеми используемыми в кардиологической практике лекарственными препаратами, за исключением верапамила и дилтиазема.
Застосування івабрадину при стенокардії
Сприятливі ефекти зниження ЧСС, що досягається на тлі застосування івабрадину, у хворих зі стенокардією (адаптовано з A. Hjal-marson, 2007; K. Fox et al., 2007):
- збільшення тривалості діастоли, збільшення доставки кисню до міокарда;
- зменшення споживання міокардом кисню;
- поліпшення фазового складу діастоли (G. Heusch, 2007) - при подовженні діастоли в цілому, фаза изоволюмического розслаблення подовжується в меншій мірі, ніж інші фази діастоли; таким чином зменшується відносний час компресії малих коронарних артерій (цей ефект властивий івабрадину, але не β-АБ);
- зменшення прогресії і ризику розриву атеросклеротичних бляшок;
- зменшення кількості та інтенсивності епізодів стенокардії;
- збільшення переносимості фізичного навантаження.
Івабрадін в даний час є повноправним компонентом лікування хворих зі стабільною стенокардією, що мають синусовий ритм (особливо при наявності протипоказань до використання β-АБ або при їх непереносимості). Цей препарат увійшов в останні Рекомендації з лікування стенокардії, представлені експертами Європи (2006). Антіангі-
ний ефект івабрадину досить істотний - для дози 15 мг / добу. за ступенем вираженості його можна порівняти з подібними ефектами 100 мг / сут. атенололу і 10 мг / сут. амлодипіну або навіть перевершує їх. Препарат показує високу антиангінальну ефективність і хорошу переносимість як у пацієнтів зі стабільною стенокардією в цілому, так і в групах літніх осіб і хворих з цукровим діабетом зокрема.
Можливі перспективи застосування івабрадину при ХСН. Дослідження BEAUTI f UL і SHI f T
Широко відомо сприятливий вплив β-АБ на прогноз при ХСН. Представники цієї групи препаратів є відповідно до вже згадуваними нами міжнародними рекомендаціями стандартом в лікуванні хворих з ХСН. Поширеною в даний час є точка зору про те, що принаймні частина позитивних ефектів β-АБ при ХСН пов'язана з досягається при їх застосуванні зменшенням ЧСС. З урахуванням важливої \u200b\u200bролі ліквідації тахікардії в зменшенні ішемії міокарда, що докладніше представлено вище, зниження ЧСС як самостійний підхід здається особливо привабливим в лікуванні ХСН ішемічного генезу. Важливим аргументом на користь можливого застосування івабрадину для селективного зниження ЧСС є те, що частина хворих, які потребують при ХСН в усуненні тахікардії, мають протипоказання до застосування β-АБ (активні астма або ХОЗЛ, гіпотензія, порушення провідності) або побічні ефекти при їх використанні ( наприклад, еректильну дисфункцію). Таким чином, теоретичні передумови застосування івабрадину при ХСН досить переконливі.
Дані дрібних досліджень про таке застосування івабрадину вже є. У недавньому дослідженні G. Jondeau et al. (2004) показані позитивні гемодинамічні та клінічні ефекти івабрадину в групі 65 хворих на ішемічну хворобу серця, що мали ХСН III функціонального класу (середній рівень фракції викиду ЛШ склав 40%). Дослідження було подвійним сліпим плацебо-контрольованим, його тривалість склала 3 місяці. Хворі отримували стандартне лікування з приводу ХСН (інгібітори АПФ, діуретики, при необхідності - дігоксин), до якого додавали івабрадін (по 10 мг 2 рази на день) або плацебо. На тлі застосування івабрадину відзначені зменшення частоти серцевих скорочень, достовірне збільшення дистанції в тесті з 6-хвилинною ходьбою, тенденція до зменшення обсягів ЛШ, особливо у хворих з вихідною ФВ ЛШ< 35 %. У этой категории больных за период лечения изменения конечно-диастолического объема ЛЖ составили для групп ивабрадина и плацебо соответственно -22 мл и +14 мл; конечно-систолического объема соответственно -24 мл и +9 мл.
З урахуванням даних про сприятливі ефекти і добру переносимість івабрадину при ІХС, патофізіологічною виправданості селективного зниження ЧСС при ХСН, а також попередні дані дрібних досліджень про позитивний вплив івабрадину при ХСН були сплановані і проводяться в даний час дослідження BEAUTI f UL і SHI f T, які ми коротко охарактеризуємо.
Рандомізоване плацебо-контрольоване подвійне сліпе дослідження BEAUTI f UL має на меті порівняти івабрадін з плацебо (при їх додаванні до стандартної терапії ХСН) щодо впливу на прогноз. У це дослідження увійшли 10 917 хворих (середній вік 65 років, 37% - з цукровим діабетом 2-го типу, 40% - з метаболічним синдромом) з доведеною хронічної ІХС при синусовому ритмі з частотою ≥ 60 уд. в хвилину (в середньому - 72 уд. за хвилину), що мають рівні фракції викиду ЛШ ≤ 39% (середній рівень фракції вигнання ЛШ 32%). До включення в дослідження хворі перебували в стабільному клінічному стані протягом не менше 3 місяців. Базисне лікування включає інгібітори АПФ або АРАII (89%), β-АБ (87%), статини (76%), антитромбоцитарні препарати (94%). Дози івабрадину складають 10 або 15 мг / добу. в залежності від рівнів ЧСС. Мінімальний період спостереження повинен скласти 12 місяців. У BEAUTI f UL є субісследованія: одне - з 24-годинним мониторированием ЕКГ - для оцінки впливу івабрадину на ЧСС та інше - з визначенням ехокардіографічних параметрів - для оцінки впливу івабрадину на структуру і функцію ЛШ. Результати BEAUTI f UL плануються до опублікування в серпні - вересні 2008 р
Ще одне велике дослідження івабрадину при ХСН - це SHI f T, яке також є рандомізованих плацебо-контрольованих подвійним сліпим. У ньому оцінюється вплив івабрадину (15 мг / сут.) На прогноз у 2750 хворих з помірною та важкою ХСН (при рівнях фракції викиду ЛШ< 35 %).
Результати цих двох досліджень дозволять більш чітко уявити прогностичну значимість ЧСС при ХСН, а також вплив на прогноз селективного зниження ЧСС. При успішному завершенні ці дослідження можуть додати новий клас препаратів (селективні інгібітори I f-каналів, зокрема івабрадін) в число рекомендованих при ХСН, а також розширити за рахунок цього препарату спектр лікарських засобів, здатних поліпшувати серцево-судинний прогноз.
Популярне
- Лікарський довідник ГЕОТАР
- Вітаміни витрум Вітрум прийом
- Ліки від серцевої недостатності і гіпертонії Карведилол: інструкція із застосування, ціна, відгуки, аналоги
- Сироп "Бронхобос": інструкція із застосування, склад, дозування для дітей та відгуки
- Мексіфін - офіційна інструкція із застосування, аналоги При порушеній функції печінки
- Діабетон МВ (60 мг): інструкція із застосування
- Нурофен для дітей свічки Застосування при порушеннях функції нирок
- Особливості застосування ретиноєвої мазі від прищів Зберігання ретиноєвої мазі
- Тайм Фактор: як і коли приймати препарат?
- Олазоль (спрей): інструкція із застосування, ціна, відгуки, аналоги, показання до застосування